为验证氧化性Cl2>Fe3+>SO2 某小组用下图所示装置进行实验(夹持仪器和甲中加热装置已略 气密
为验证氧化性Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和甲中加热装置已略,气密性已检验)。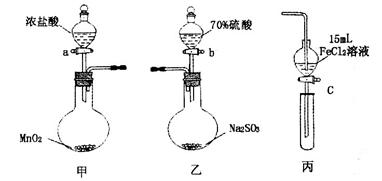 实验步骤: 1.在甲装置中,打开活塞a,加热,待装置中充满黄绿色气体时,与丙装置连接。 2.当丙装置中FeC12溶液变黄时,停止加热。 3.打开活塞c,使约2mL的溶液滴入试管中,检验溶液中的离子。 4.在乙装置中,打开活塞b,待空气排尽后,将乙中产生的气体通入上述丙装置变黄后的溶液中,一段时间后,停止。 5.更新丙中试管,打开活塞c,使约2mL的溶液滴入试管中,检验溶液中的离子。 回答下列问题: (1)甲中发生反应的化学方程式为______________________。 (2)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是____________。 (3)实验中,证明氧化性Fe3+>SO2的离子方程式为_____________。 (4)有I、II、III三组同学分别完成了上述实验,实验结果如下:
上述实验结果一定能够证明Cl2>Fe3+>SO2的是______(填“I”、“II”或“III”)。 |
参考解答
(1)MnO2+4HCl(浓)  MnCl2+2H2O+Cl2↑(2)70%的硫酸中c(H+)比98%的硫酸大 MnCl2+2H2O+Cl2↑(2)70%的硫酸中c(H+)比98%的硫酸大(3)2Fe3++SO2+2H2O=2Fe2++SO42-+4H+(4)I、Ⅲ(有错不得分,选不全得1分)(每空2分) |
试题分析:(1)在加热的条件下二氧化锰钠氧化浓盐酸生成氯气,所以甲中发生反应的化学方程式为MnO2+4HCl(浓)  MnCl2+2H2O+Cl2↑。 MnCl2+2H2O+Cl2↑。(2)应用70%的硫酸中c(H+)比98%的硫酸中c(H+)大,氢离子浓度大反应速率快。 (3)铁离子具有氧化性,能把SO2氧化生成硫酸,反应的离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+。 (4)步骤3溶液中含有铁离子生成,说明氯气把亚铁离子氧化生成铁离子。根据氧化剂的氧化性强于氧化产物的氧化性可知,氧化性是氯气强于铁离子;I组实验中既有Fe3+又有Fe2+,这说明氯气不足。因此能与SO2反应的只有铁离子。由于步骤5溶液中含有SO42-,这说明铁离子把SO2氧化生成了硫酸,因此氧化性是铁离子强于SO2,I正确;Ⅱ组实验中有Fe3+无Fe2+,因此不能排除氯气是否过量。实验即使步骤5溶液中含有SO42-,也不能说明是被铁离子氧化的,所以无法证明氧化性是铁离子强于SO2。Ⅲ组实验中有Fe3+无Fe2+,虽然不能说明氯气是否过量。但由于在步骤5溶液中含有亚铁离子,这说明在反应中铁离子被SO2还原,所以可以证明氧化性是铁离子强于SO2,答案选I、Ⅲ。 |
相似问题
2008年9月25日晚9时10分 我国“神舟七号”载人飞船顺利升入太空 此次火箭的主要燃料是偏二甲肼
2008年9月25日晚9时10分,我国“神舟七号”载人飞船顺利升入太空,此次火箭的主要燃料是偏二甲肼(用R表示)和四氧化二氮,在火箭发射时,两者剧烈反应产
K35ClO3晶体与H37Cl溶液反应后 生成氯气 氯化钾和水 下列说法正确的是[ ]A.氯
K35ClO3晶体与H37Cl溶液反应后,生成氯气、氯化钾和水,下列说法正确的是[ ]A 氯化钾是还原产物 B 有两种元素的化合价发生了变化 C 被氧化的K35ClO3和
下列进行性质比较的实验 不合理的是A.比较Cu Fe的还原性:铜加入硫酸铁溶液中B.比较氯的非金属性
下列进行性质比较的实验,不合理的是A.比较Cu、Fe的还原性:铜加入硫酸铁溶液中B.比较氯的非金属性强于溴:溴化钠溶液中通入氯气C.比较高锰酸钾的氧化性
在浓盐酸中H3AsO3与SnCl2反应的离子方程式为3SnCl2+12Cl-+2H3AsO3+6H+
在浓盐酸中H3AsO3与SnCl2反应的离子方程式为3SnCl2+12Cl-+2H3AsO3+6H+=2As+3SnCl62—+6M。下列关于该反应的说法中,错误的是( )A.M为H2OB.每
As2S3和As2O3物质相似 均具有还原性;Na2S2和Na2O2性质相似 均具有氧化性 当As2
As2S3和As2O3物质相似,均具有还原性;Na2S2和Na2O2性质相似,均具有氧化性,当As2S3与Na2S2相互反应时,生成的盐可能是: [ ]A、NaAsS3 B、Na2As












