某兴趣小组设计出下图所示装置来进行“铜与硝酸反应”实验 以探究化学实验的绿色化.(1)实验前 关闭活
| 某兴趣小组设计出下图所示装置来进行“铜与硝酸反应”实验,以探究化学实验的绿色化. (1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c,其目的是______. (2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2mL浓硝酸.c中反应的化学方程式是______;再由a向c中加2mL蒸馏水,c中的实验现象是______. (3)上表是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是______,原因是______. (4)该小组还用上述装置进行实验证明氧化性KMnO4>Cl2>Br2,则c中加入的试剂是______ d中加入的试剂是______,实验现象为______;但此实验的不足之处是______. 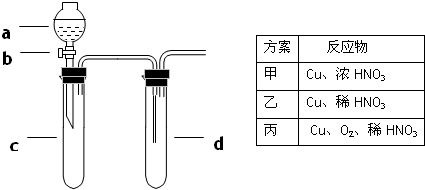 |
参考解答
| (1)因实验前要检查装置气密性,这是检查装置气密性的常见方法,故答案为:检查装置气密性; (2)因铜与浓硝酸反应:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,由a向c中加2mL蒸馏水,硝酸进行的稀释,反应变缓,同时因二氧化氮能与水反应:3NO2+2H2O=2HNO3+NO,c中气体颜色变浅,故答案为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;反应变缓,气体颜色变淡; (3)铜与浓硝酸制取硝酸铜时的方程式是:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,生成的NO2会造成大气污染,硝酸的利用率为
铜与稀硝酸制取硝酸铜时的方程式是:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,生成的NO也会造成大气污染,硝酸的利用率为
此过程用方程式可表示为:2Cu+O2
(4)根据氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性,利用KMnO4与浓盐酸反应:2KMnO4KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O, 再利用产生的氯气与KBr溶液反应得到溴:Cl2+2KBr=2KCl+Br2,所以c中有黄绿色气体产生,d中溶液变为黄棕色,同时要注意尾气吸收, 故答案为:KMnO4;KBr溶液(含Br-的溶液);c中有黄绿色气体产生,d中溶液变为黄棕色;没有处理尾气. |
相似问题
下列物质久置于空气中会发生相应的变化 其中发生了氧化还原反应的是 [ ]A.浓硫酸的体
下列物质久置于空气中会发生相应的变化,其中发生了氧化还原反应的是[ ]A.浓硫酸的体积增大B.铝的表面生成致密的薄膜 C.澄清的石灰水变浑浊D.氢氧
根据下列反应 判断氧化性强弱正确的是( )①2H2S+O2=2S+2H2O ②Na2S+I
根据下列反应,判断氧化性强弱正确的是( )①2H2S+O2=2S+2H2O②Na2S+I2=2NaI+S③4NaI+O2+2H2O=2NaOH+2I2.A.O2>I2>SB.O2>S>I2C.I2>O2>SD.S>I2>O2
氮化铝(AlN)具有耐高温 抗冲击 导热性好等优良性质 被广泛应用于电子工业 陶瓷工业等领域。在一定
氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:Al2O3+N2+3C2
往蓝色的CuSO4溶液中逐滴加入KI溶液可以观察到产生白色沉淀X和生成含有Y物质的棕色溶液。再向反应
往蓝色的CuSO4溶液中逐滴加入KI溶液可以观察到产生白色沉淀X和生成含有Y物质的棕色溶液。再向反应后的混合物中不断通入SO2气体,并加热,又发现白色沉淀
下图所示的微粒中 氧化性最强的是( )A.B.C.D.
下图所示的微粒中,氧化性最强的是( )A.B.C.D.












