(1)某学生用KMnO4制备氯气 反应方程式如下:2KMnO4 + 16HCl = 2KCl + 2
| (1)某学生用KMnO4制备氯气,反应方程式如下: 2KMnO4 + 16HCl = 2KCl + 2MnCl 2+ 5Cl 2↑ + 8H2O 当有15.8g KMnO4参加反应时,消耗 molHCl,其中被氧化的HCl有 mol,有 mol电子转移,标准状况下生成Cl 2的体积为 L。 (2)生成的氯气缓慢通入KI-淀粉溶液中,出现蓝色,离子方程式为 ,若氯气用量(物质的量)达到KI的3倍时,蓝色完全消失,已知此时生成物中含碘物质只有一种,那么该物质中碘的化合价为 。 |
参考解答
| (1)0.8 0.5 0.5 5.6 (2)Cl2 + 2I-= I2 + 2Cl- +5 |
试题分析:(1)15.8g高锰酸钾的物质的量是15.8g÷158g/mol=0.1mol,则根据反应的化学方程式可知,参加反应的氯化氢是0.1mol×8=0.8mol。其中被氧化的氯化氢是 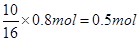 。氯元素的化合价从-1价升高到0价,失去1个电子,则转移电子的物质的量是0.5mol×1=0.5mol。根据方程式可知,生成氯气的体积在标准状况下是0.25mol×22.4L/mol=5.6L。 。氯元素的化合价从-1价升高到0价,失去1个电子,则转移电子的物质的量是0.5mol×1=0.5mol。根据方程式可知,生成氯气的体积在标准状况下是0.25mol×22.4L/mol=5.6L。(2)氯气具有氧化性,能把碘化钾氧化生成单质碘,反应的离子方程式是Cl2 + 2I-= I2 + 2Cl-。设参加反应的碘化钾是1mol,则氯气是3mol,所以根据电子的得失守恒可知,1mol碘化钾失去3mol×2=6mol,则反应后碘元素的化合价是+5价。 点评:该题是中等难度的试题,试题基础性强,侧重对学生能力的培养和解题方法的指导,有助于培养学生的逻辑推理能力和灵活应变能力。该题的关键是准确判断出有关元素的化合价变化情况,然后根据电子的得失守恒即可得出正确的结论。 |
相似问题
现有M N P E四种元素 有以下反应:(1)在水溶液中 M+N2+═M2++N (2)P+2H2O
现有M、N、P、E四种元素,有以下反应:(1)在水溶液中,M+N2+═M2++N,(2)P+2H2O(l)═P(OH)2+H2↑,(3)N、E相连浸入稀H2SO4中,电极反应:N-2e-
(6分)氧化一还原反应实际上是含氧化反应和还原反应二个过程 一个还原反应过程如下:NO3—+4H++
(6分)氧化一还原反应实际上是含氧化反应和还原反应二个过程,一个还原反应过程如下:NO3—+4H++ 3e—NO+ 2H2O下列四种物质:KMnO4,Na2CO3,KI,Fe2
已知2FeCl3 + 2KI = 2FeCl2 + 2KCl + I2 H2S + I2 =' 2H
已知2FeCl3 + 2KI = 2FeCl2 + 2KCl + I2,H2S + I2 = " 2HI " + S,下列叙述正确的是()A.氧化性:Fe3+>I2>SB.氧化性:I2>S>Fe3+C.还原性:Fe2+>I->H2SD.还原性:Fe2+>H2S>I-
已知下面六句话:①A氧化B ②B氧化A ③A被B氧化 ④B被A氧化 ⑤A被B还原 ⑥B被A还原。其中
已知下面六句话:①A氧化B,②B氧化A,③A被B氧化,④B被A氧化,⑤A被B还原,⑥B被A还原。其中和第一句话的意思相同的是A.②③B.②④C.⑤⑥D.④⑤
交警测试司机是否酒后驾驶 30秒就能见分晓 酒精测试仪中用了CrO3 反应后转化为Cr2(SO4)3
交警测试司机是否酒后驾驶,30秒就能见分晓,酒精测试仪中用了CrO3,反应后转化为Cr2(SO4)3。则酒精在此过程中()A.发生了氧化反应B.发生了还原反应C












