室温下向20mL c(OH-)=0.3mol/L的NaOH与Ba(OH)2溶液中滴加0.05mol/
| 室温下向20mL、c(OH-)=0.3mol/L的NaOH与Ba(OH)2溶液中滴加0.05mol/L的硫酸并不断地振荡,产生的沉淀随所加硫酸的体积(V)变化关系如图(混合体积的微小变化忽略不计): (1)图中A点的意义是______,原混合溶液中Ba(OH)2为______mol/L (2)当滴加H2SO4的体积至V2时,混合溶液的pH=7,则V2=______mL. 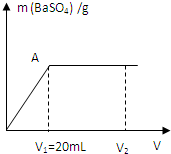 |
参考解答
(1)由图可知,A点沉淀达最大值,故A点Ba2+恰好反应完,此时消耗的硫酸体积为20mL,则n(H2SO4)=0.02L×0.05mol/L=0.001mol,n(SO42-)=(H2SO4)=0.001mol,由离子方程式Ba2++SO42-=BaSO4↓可知n(Ba2+)=n(SO42-)=0.001mol,故n[Ba(OH)2=n(Ba2+)=0.001mol,氢氧化钡的物质的量浓度为
故答案为:Ba2+恰好反应完;0.05; (2)溶液pH=7,则氢氧化钠、氢氧化钡电离的氢氧根离子与硫酸电离的氢离子恰好完全反应,故硫酸电离产生的n(H+)=n(OH-)=0.02L×0.3mol/L=0.006mol,则n(H2SO4)=
故答案为:60. |
相似问题
下列离子方程式书写正确的是( )A.利用腐蚀法制作印刷线路板:Cu+Fe3+=Cu2++Fe2+B
下列离子方程式书写正确的是( )A.利用腐蚀法制作印刷线路板:Cu+Fe3+=Cu2++Fe2+B.硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO42ˉ=BaSO4↓C.氧化铝与
某些金属氧化物跟熔融烧碱反应可以生成盐 根据下面化学反应框架图填空.(1)单质F是______ (2
某些金属氧化物跟熔融烧碱反应可以生成盐,根据下面化学反应框架图填空.(1)单质F是______,(2)写出由E生成G的离子方程式(或化学方程式)______.(
用等体积等物质的量浓度的BaCl2溶液可使相同体积的Fe2(SO4)3 FeSO4 K2SO4三种溶
用等体积等物质的量浓度的BaCl2溶液可使相同体积的Fe2(SO4)3、FeSO4、K2SO4三种溶液中的SO42-离子恰好完全转化为沉淀.则三种溶液的物质的量浓度之比为
在硝酸铅[Pb(NO3)2]的稀溶液中滴入几滴稀硫酸 生成白色PbSO4沉淀 再滴入数滴饱和醋酸钠溶
在硝酸铅[Pb(NO3)2]的稀溶液中滴入几滴稀硫酸,生成白色PbSO4沉淀,再滴入数滴饱和醋酸钠溶液,微热并不断搅动,沉淀慢慢溶解.以上发生的都是复分解反
下列化学反应 能用离子方程式H++OH-=H2O表示的是( )A.澄清石灰水与盐酸反应B.氢氧化钡
下列化学反应,能用离子方程式H++OH-=H2O表示的是( )A.澄清石灰水与盐酸反应B.氢氧化钡溶液和稀硫酸反应C.氢氧化镁和稀硝酸反应D.氢氧化钠溶液












