(三选一)[选修3:物质结构与性质]氢能被视作连接化石能源和可再生能源的重要桥梁。(1)水是制取H2
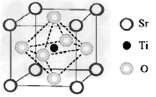
| (三选一)[选修3:物质结构与性质] 氢能被视作连接化石能源和可再生能源的重要桥梁。 (1)水是制取H2的常见原料,下列有关水的说法正确的是________________ 。 a.水分子是一种极性分子 b.H2O分子中有2个由s轨道与sp3杂化轨道形成的 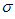 键 键 c.水分子空间结构呈V型 d.CuSO4·5H2O晶体中所有水分子都是配体 (2)氢的规模化制备是氢能应用的基础。在光化学电池中,以紫外线照钛酸锶电极时,可分解水制取H2同时获得O2。已知钛酸锶晶胞结构如图所示,则钛酸锶的化学式为_______________。 |
 |
| (3)氢的规模化储运是氢能应用的关键。 ①准晶体Ti38Zr45Ni17的储氢量较高,是一种非常有前途的储氢材料。该材料中,镍原子在基态时核外电子排布式为_________________。 ②氨硼烷化合物(NH3BH3)是最近密切关注的一种新型化学氢化物储氢材料。请画出含有配位键(用“→”表示)的氨硼烷的结构式_____________;与氨硼烷互为等电子体的有机小分子是_________________;(写结构简式)。 ③甲酸盐/碳酸盐可用于常温储氢,其原理是:甲酸盐在钌催化下会释放出氢气,产生的CO2被碳酸盐捕捉转变碳酸氢盐,碳酸盐又能催化转化为甲酸盐。已知HCO3-在水溶液中可通过氢键成为二聚体(八元环结构),试画出双聚体结构____________ 。 |
参考解答
| (1)abc (2)SrTiO3 (3)①1s22s22p63s23p63d84s2 或[Ar3d84s2 |
②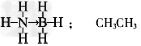 ③ 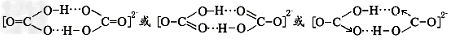 |
相似问题
下列分子中 具有极性键的非极性分子的组合是[ ]A.H2 NH3 H2S B.CS2 BF3
下列分子中,具有极性键的非极性分子的组合是[ ]A.H2、NH3、H2S B.CS2、BF3、CO2C.CH3Cl、CH2Cl、CH4D.SO2、NO2、C2H2
最近意大利罗马大学的科学家获得了极具理论研究意义的N4分子.N4分子结构如图所示 已知断裂1molN
最近意大利罗马大学的科学家获得了极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂1molN-N吸收167kJ热量,生成1molN≡N放出942kJ热量,根据以上
(1)氧化物MO与SiC属于等电子体 则M2+的核外电子排布式为____;MO的熔点比CaO的高 原
(1)氧化物MO与SiC属于等电子体,则M2+的核外电子排布式为____;MO的熔点比CaO的高,原因是___。 (2)K3[Fe(CN)6]晶体中含有的化学键类型为___;CN-中碳原
极性分子易溶于极性分子中 而非极性分子易溶于非极性分子中 又叫相似相溶原理。PtCl2(NH3)2为
极性分子易溶于极性分子中,而非极性分子易溶于非极性分子中,又叫相似相溶原理。PtCl2(NH3)2为平面正方形结构,它可以形成两种固体:一种为淡黄色,在水
将几种物质在水和四氯化碳中的溶解情况填入下表(3)其原因是_____________________
将几种物质在水和四氯化碳中的溶解情况填入下表(3)其原因是________________________












