A B C D E五种短周期元素 原子序数依次递增.A原子形成的阳离子是一个质子 B原子的最外层电子
| A、B、C、D、E五种短周期元素,原子序数依次递增.A原子形成的阳离子是一个质子,B原子的最外层电子数是次外层的2倍,C原子的最外层电子数与B原子的核外电子总数相等,D在同周期元素中原子半径最大,E与C是同主族元素.C、D两种元素可形成化合物甲,甲中既有离子键又有共价键;A、B、C、D四种元素可形成化合物乙,乙放入水中所得溶液显碱性.请回答: (1)化合物甲的电子式为______;乙的化学式有很多种,其中无机物是______,相对分子质量最小的有机物是______. (2)气体A2、C2和A、C、D形成的离子化合物的水溶液可形成燃料电池,其正极的电极反应式为______,电池总反应得到1.8g产物时,流经外电路某一横截面的电子数为______. (3)A、B能形成无数种化合物,其中密度最小的气态化合物燃烧热为890.3 kJ/mol,该化合物燃烧的热化学方程式为______. (4)都由A、C、D、E形成的两种化合物可以相互反应,其离子方程式为______.  |
参考解答
| A原子形成的阳离子是一个质子,则A为H元素,B原子的最外层电子数是次外层的2倍,应为C元素,C原子的最外层电子数与B原子的核外电子总数相等,应为O元素,D在同周期元素中原子半径最大,应为Na元素,E与C是同主族元素,则E为S元素, (1)O、Na两种元素可形成化合物甲,甲中既有离子键又有共价键,则甲为Na2O2,电子式为Na+[ 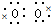 2-Na+,A、B、C、D四种元素可形成化合物乙,乙放入水中所得溶液显碱性,常见的物质为NaHCO3、CH3COONa等,为强碱弱酸盐,水解呈碱性,其中NaHCO3为无机物,CH3ONa为相对分子质量最小的有机物, 故答案为:Na+[ 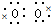 2-Na+;NaHCO3;CH3ONa; (2)气体A2、C2和A、C、D形成的离子化合物的水溶液形成的为碱性氢氧燃料电池,电池工作时,正极发生还原反应,电极反应式为O2+2H2O+4e-═4OH-,电池总反应为2H2+O2=2H2O,n(H2O)=
故答案为:O2+2H2O+4e-═4OH-;1.204×1023(或0.2NA); (3)A、B形成的密度最小的化合物为CH4,根据燃烧热可知热化学方程式为CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3 kJ?mol-1, 故答案为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3 kJ?mol-1; (4)都由A、C、D、E形成的两种化合物可以相互反应,这两种化合物分别为NaHSO4、NaHSO3,二者反应的离子方程式为H++HSO3-═SO2↑+H2O, 故答案为:H++HSO3-═SO2↑+H2O. |
相似问题
下列说法中错误的是( )A.原子及其离子的核外电子层数等于该元素所在的周期数B.元素周期表中从ⅢB
下列说法中错误的是( )A.原子及其离子的核外电子层数等于该元素所在的周期数B.元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素C.除氦以外
已知X Y Z W R是原子序数依次增大的短周期主族元素 X是周期表中原子半径最小的元素 Y元素的最
已知X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X是周期表中原子半径最小的元素,Y元素的最高正价与最低负价绝对值相等,Z的核电荷数是Y的2倍,W
下列各组表述中 两个微粒不属于同种元素原子的是[ ]A.3p能级有一个空轨道的基态原子和核外
下列各组表述中,两个微粒不属于同种元素原子的是[ ]A.3p能级有一个空轨道的基态原子和核外电子的排布为1s22s22p63s23p2的原子B.2p能级无空轨道,且有
以下有关原子结构及元素周期律的叙述正确的是( )A.第 IA 族元素铯的两种同位素137Cs 比1
以下有关原子结构及元素周期律的叙述正确的是( )A.第IA族元素铯的两种同位素137Cs比133Cs多4个质子B.同周期元素(除0族元素外)从左到右,原子半
下列有关NaH的叙述中正确的是[ ]A.NaH在水中显酸性 B.NaH中氢离子的电子层排布与
下列有关NaH的叙述中正确的是[ ]A.NaH在水中显酸性 B.NaH中氢离子的电子层排布与氦原子的相同 C.NaH中氢离子具有还原性 D.NaH中氢离子可被还原成氢气












