a b c d e是同周期的五种元素 a和b的最高价氧化物对应水化物呈碱性 且碱性b>a;c和d的气
a、b、c、d、e是同周期的五种元素,a和b的最高价氧化物对应水化物呈碱性,且碱性b>a;c和d的气态氢化物的还原性d>c;五种元素的原子得失电子后所形成的简单离子中e的离子半径最小,则它们的原子序数由小到大的顺序是( )
|
参考解答
a和b的最高价氧化物对应水化物呈碱性,则a、b为金属,且失电子能力b>a(其最高价氧化物对应水化物的碱性b>a);c和d的气态氢化物的还原性d>c,即c、d为非金属,且得电子能力d<c.根据同周期元素从左到右失电子能力逐渐减弱,得电子能力逐渐增强的规律,将a、b、c、d四种元素大致排序为: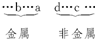 因为五种元素的原子得失电子后所形成的简单离子中e的离子半径最小,则e应为金属元素,且原子序数b<a<e(如Na、Mg、Al). 故选C. |
相似问题
现有5种短周期元素X Y Z Q W 原子序数依次增大 在周期表中X原子半径最小;X和W同主族;Y元
现有5种短周期元素X、Y、Z、Q、W,原子序数依次增大,在周期表中X原子半径最小;X和W同主族;Y元素原子核外电子总数是其次外层电子数的3倍;Q元素是地壳
A B C D E五种元素的原子序数依次增大 且均小于18;A原子的最外层比B原子的最外层少2个电子
A、B、C、D、E五种元素的原子序数依次增大,且均小于18;A原子的最外层比B原子的最外层少2个电子,A原子的最外层电子数是次外层电子数的两倍;A、B、C三
根据以下事实得出的判断一定正确的是[ ]A.0.1mol/LNaHCO3溶液中 c(OH-)
根据以下事实得出的判断一定正确的是[ ]A.0 1mol LNaHCO3溶液中,c(OH-)-C(H+)=c(H2CO3)-c(CO32-)B.A+和B-的电子层结构相同,则A原子的核电荷数比B
某元素为非金属元素 该元素的原子结合一个电子即达到稳定结构 则下列关于该元素的描述中一定正确的是(
某元素为非金属元素,该元素的原子结合一个电子即达到稳定结构,则下列关于该元素的描述中一定正确的是( )A.第ⅦA族的卤素B.主族元素C.副族元素D
有X Y Z W四种主族元素 已知阳离子X Y和阴离子Z W具有相同的电子层结构 并且离子半径X>Y
有X、Y、Z、W四种主族元素,已知阳离子X、Y和阴离子Z、W具有相同的电子层结构,并且离子半径X>Y,阴离子所带电荷数Z>W.则四种元素的原子序数大小顺序












