有A B C D E五种短周期元素 A元素的一种同位素原子核内不含中子 其单质为气体;B原子最外层电
| 有A、B、C、D、E五种短周期元素,A元素的一种同位素原子核内不含中子,其单质为气体;B原子最外层电子数是次外层电子数的3倍,C 2+与B元素的离子具有相同的电子层结构;D与E原子具有相同的电子层数,且次外层电子数均为8;在同周期主族元素中原子半径E最大,D最小.回答下列问题: (1)C 2+离子与D原子的结构示意图分别为:______、______. (2)B和E形成的两种化合物的电子式是:______、______ 其中之一可与A 和B形成的化合物反应得到游离态B,写出该反应的化学方程式:______. (3)由这五种元素中的几种形成的化合物中碱性最强的是______(化学式),含氧酸酸性最强的是______(化学式). |
参考解答
| 有A、B、C、D、E五种短周期元素,A元素的一种同位素原子核内不含中子,其单质为气体,则A为H元素;B原子最外层电子数是次外层电子数的3倍,则最外层电子数为6,即B为O元素;C 2+与B元素的离子具有相同的电子层结构,则C的质子数为8+2+2=12,即C为Mg元素;D与E原子具有相同的电子层数,且次外层电子数均为8,则D、E均在第三周期,在同周期主族元素中原子半径E最大,D最小,则E为Na,D为Cl, (1)镁离子的结构示意图为 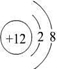 ,氯原子的结构示意图为 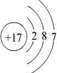 ,故答案为:  ;  ; (2)B和E形成的两种化合物为Na2O、Na2O2,电子式分别为 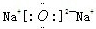 、 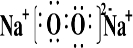 ,过氧化钠与水反应生成氧气,反应的化学方程式为 2Na2O2+2H2O=4NaOH+O2↑, 故答案为: 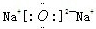 ; 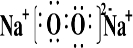 ;2Na2O2+2H2O=4NaOH+O2↑; (3)五种元素中,Na的金属性最强,则NaOH的碱性最强;Cl的非金属性最强,则HClO4的酸性最强, 故答案为:NaOH;HClO4. |
相似问题
下列说法正确的是( )A.副族中没有非金属元素B.原子最外层只有1个电子的元素一定是金属元素C.氟
下列说法正确的是( )A.副族中没有非金属元素B.原子最外层只有1个电子的元素一定是金属元素C.氟元素的最高化合价在数值上等于它所属的族序数D.除
X Y两元素的质子数之和为22 X的原子核外电子数比Y少6个 下列说法中不正确的是( )A.Y的单
X、Y两元素的质子数之和为22,X的原子核外电子数比Y少6个,下列说法中不正确的是( )A.Y的单质是金属晶体B.X的单质固态时为分子晶体C.X与碳形成的
酸根RO2-3所含电子数比硝酸根NO-3的电子数多8 则下列说法正确的是( )A.R和N为同族元素
酸根RO2-3所含电子数比硝酸根NO-3的电子数多8,则下列说法正确的是( )A.R和N为同族元素B.RO2-3中R的化合价与NO-3中的N的化合价相等C.RO2-3即能被
短周期主族元素R的族序数是其周期序数的2倍 R在其最高价氧化物中的质量分数为40% 并且R原子核内的
短周期主族元素R的族序数是其周期序数的2倍,R在其最高价氧化物中的质量分数为40%,并且R原子核内的质子数与中子数相等.(1)确定R元素名称?(2)R元素
基态原子的4s能级中只有1个电子的元素共有[ ]A.1种B.2种 C.3种 D.8种
基态原子的4s能级中只有1个电子的元素共有[ ]A.1种B.2种 C.3种 D.8种












