现有元素周期表中前20号五种元素:A B C D E A的原子核中没有中子;B C元素处于同一周期
| 现有元素周期表中前20号五种元素:A、B、C、D、E,A的原子核中没有中子;B、C元素处于同一周期,C的原子半径较小,B、C的质子数之和为27,质子数之差为5;0.9g D的单质跟足量盐酸反应,生成D3+和1.12L(标况)氢气;E和C能形成E2C型离子化合物,且E、C两元素的简单离子具有相同电子层结构. (1)写出各元素符号: A______,B______,C______,D______,E______. (2)B、D的最高价氧化物对应水化物相互反应的离子方程式为:______. (3)用电子式表示C与E形成E2C的过程:______. |
参考解答
现有元素周期表中前20号五种元素:A、B、C、D、E.A的原子核中没有中子,则A为氢元素;B、C元素处于同一周期,C的原子半径较小,B、C的质子数之和为27,质子数之差为5,令B、C质子数分别为x、y,则x+y=27,y-x=5,解得x=11,y=16,故B为钠元素,C为硫元素;0.9g D的单质跟足量盐酸反应,生成D3+和1.12L(标况)氢气,令D的相对分子质量为z,则
(1)由分析可知,A为H元素;B为Na元素;C为S元素;D为Al元素;E为K元素,故答案为:H;Na;S;Al;K; (2)B、D的最高价氧化物对应水化物为NaOH、Al(OH)3,氢氧化钠与氢氧化铝反应生成偏铝酸钠与水,二者相互反应的离子方程式为OH-﹢Al(OH)3=AlO2-﹢2H2O, 故答案为:OH-﹢Al(OH)3=AlO2-﹢2H2O; (3)K2S是离子化合物,由钾离子与硫离子构成,用电子式表示K2S的形成过程为 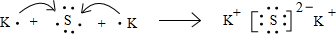 , 故答案为: 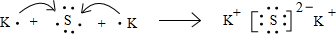 . |
相似问题
已知A B C D的原子序数都不超过18 它们的离子aA(n+1)+ bBn+ cC(n+1)- d
已知A、B、C、D的原子序数都不超过18,它们的离子aA(n+1)+、bBn+、cC(n+1)-、dDn-均具有相同的电子层结构,则下列叙述正确的是( )A.原子序数:
设X Y Z代表3种元素.已知:①X+和Y-两种离子具有相同的电子层结构;②Z元素原子核内质子数比Y
设X、Y、Z代表3种元素.已知:①X+和Y-两种离子具有相同的电子层结构;②Z元素原子核内质子数比Y原子核内质子数少9个;③Y和Z两种元素可以形成4核42个电
如图是磷的原子结构示意图 由此可知磷元素位于元素周期表中的第______周期 第______族.
如图是磷的原子结构示意图,由此可知磷元素位于元素周期表中的第______周期,第______族.
主族元素R的原子其电子式可用下式表示:.该元素组成的以下物质 其分子式肯定错误的是( )A.含氧酸
主族元素R的原子其电子式可用下式表示:.该元素组成的以下物质,其分子式肯定错误的是( )A.含氧酸分子式可能为H3RO4B.含氧酸分子式可能为HRO3C.
如果发现了原子序数为116的元素 对它的正确叙述是下列组合中的( )①位于第七周期;②是非金属元素
如果发现了原子序数为116的元素,对它的正确叙述是下列组合中的( )①位于第七周期;②是非金属元素;③最外电子层含有6个电子;④没有放射性;⑤属












