(11分)已知短周期元素X W Z Y核电荷数依次增大。X为原子半径最小的元素 W的最外层电子数是次
| (11分)已知短周期元素X、W、Z、Y核电荷数依次增大。X为原子半径最小的元素,W的最外层电子数是次外层的二倍,Y的最外层电子数为电子层数的三倍。 (1)写出Z单质的电子式_______________________ (2)由X、W、Z三种元素可组成火箭燃料甲,三种元素质量比为2∶6∶7,甲蒸气密度是同温同压下氢气密度的30倍,甲分子式________。Z、Y可形成多种化合物,其中化合物乙Z2Y4可做为火箭燃料燃烧时的供氧剂。虽然化合物甲与乙都有毒,但燃烧产物却无毒。写出化合物甲与乙反应的化学方程式: ________________________ 该反应生成物能量总和 (填“大于”、“小于”或“等于”)反应物能量总和。 (3)X、Y两种元素的单质已被应用于字宙飞船的燃料电池中,如图所示,两个电极均由多孔性碳构成,通入的两种单质由孔隙逸出并在电极表面放电。 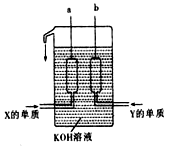 ①b是电池的_____________极,a电极上的电极反应式是_________________________,消耗n molY单质时电池内转移的电子个数约为_______________。 ②如果燃料电池中,a电极上改为通入X与W两种元素形成 的化合物丙(其它条件不变)写出b电极上的电极反应式是_________________________________。 ③如果只把燃料电池电解质改为掺入了三氧化二釔的ZrO2晶体,它在高温下传导O2-(其它条件不变),电池工作时,固体电解质里的O2-向____________极(填a或b)移动,正极反应式为________________________。 |
参考解答
(1) 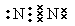 (1分) (1分)(2) C2H8N2(1分)。C2H8N2+2N2O4=2CO2↑+3N2↑+4H2O↑(2分) 小于。(1分) (3)①正极(1分),2H2+4OH――4e-=4H2O(1分)。4nNA(1分) ②O2+2H2O+4e-=4OH―(1分) ③a (1分) O2+4e-=2O2-(1分) |
| 根据元素的结构及性质可知,X、W、Z、Y分别为H、C、N、O。 (1)氮气中含有三键,电子式为 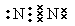 。 。(2)三种元素的质量之比是2∶6∶7,所以原子个数之比是4∶1∶1。又因为甲蒸气密度是同温同压下氢气密度的30倍,所以甲的相对分子质量是60,则其分子式为C2H8N2。因为燃烧产物无毒,所以产物是氮气、CO2和水,方程式为C2H8N2+2N2O4=2CO2↑+3N2↑+4H2O↑。由于是放热反应,所以生成物的总能量小于反应物的总能量。 (3)①原电池中负极失去电子,正极得到电子。所以氢气在负极通入,正极在正极通入。所以b是正极,a是负极,电极反应式为2H2+4OH――4e-=4H2O。1mol氧气在反应中得到4mol电子,所以反应式中转移的电子的数量为4nNA。 ②b电极通入的是氧气,反应式为O2+2H2O+4e-=4OH―。 ③原电池中电子经导线传递到正极,所以阳离子向正极移动,阴离子向负极移动。正极氧气得到电子,反应式为O2+4e-=2O2-。 |
相似问题
下列说法不正确的是( ) A.共价化合物和离子化合物中 一定都含有非金属元素B.某元素原子最外
下列说法不正确的是()A.共价化合物和离子化合物中,一定都含有非金属元素B.某元素原子最外层只有1个电子,它跟卤素可能形成离子键也可能形成共价键C
下列说法错误的是( )A.化学反应实质是旧键断裂和新键形成B.极性键就是共用电子对发生偏移的共价键
下列说法错误的是()A.化学反应实质是旧键断裂和新键形成B.极性键就是共用电子对发生偏移的共价键C.氢键是一种比较弱的化学键D.水结冰时体积膨胀、
(10分)“西气东输”是西部开发的重点工程 这里的气体是指天然气 其主要成分是甲烷。工业上将碳与水在
(10分)“西气东输”是西部开发的重点工程,这里的气体是指天然气,其主要成分是甲烷。工业上将碳与水在高温下反应制得水煤气,水煤气的主要成分是CO和H
根据下表所列键能数据 下列分子中最不稳定的分子是化学键H-HH-CIH-BrCI-CIBr-Br键能
根据下表所列键能数据,下列分子中最不稳定的分子是化学键H-HH-CIH-BrCI-CIBr-Br键能( KJ·mol-1)436431299247193A、HCI B、HBr C、H2 D、Br2
下列叙述正确的是 ( )A.氯化钠晶体不能导电 所以氯化钠不是电解质B.氯
下列叙述正确的是 ( )A.氯化钠晶体不能导电,所以氯化钠不是电解质B.氯化钠溶液能导电,所以氯化钠溶液是电解质C.熔融的氯化钠和氯化钠溶液都能产生












