下列说法正确的是( )A.在0.1mol?L-1Na2CO3溶液中 加两滴酚酞显浅红色 微热后红色
下列说法正确的是( )
|
参考解答
| A.滴有酚酞的Na2CO3溶液显示红色,是由于碳酸钠溶液中的碳酸根离子水解溶液呈碱性,其中碳酸根离子水解程度受温度的影响,微热,溶液颜色逐渐变深,说明温度高,水解程度大,碱性增强,所以盐类水解是吸热反应,故A正确; B.含有固体MgCO3的MgCl2、Na2CO3溶液中,c(Mg2+)不一定等于c(CO32-),但c(Mg2+)?c(CO32-)=6.82×10-6 mol2?L-2,故B错误; C.当体积、pH都为3的酸HA和HB分别与足量的锌反应,HA放出的氢气多,说明HA的物质的量大于HB的物质的量,溶液的体积相等,HA的物质的量浓度大于HB的,所以说明酸性:HA<HB,故C错误; D.因为苯环中的碳碳键是介于单双键之间的一种独特的键,不存在典型的碳碳双键和碳碳单键,不能用以上表中进行计算,故D错误; 故选:A. |
相似问题
下列叙述错误的是( )A.原子间通过共用电子对形成的化学键叫共价键B.阴 阳离子之间通过静电作用形
下列叙述错误的是( )A.原子间通过共用电子对形成的化学键叫共价键B.阴、阳离子之间通过静电作用形成的化学键叫做离子键C.化学键是相邻的原子之间
化学反应可以从多种角度认识和分析 下列对化学反应的认识错误的是( )A.反应物中化学键断裂 生成物
化学反应可以从多种角度认识和分析,下列对化学反应的认识错误的是( )A.反应物中化学键断裂、生成物中化学键形成,同时伴随能量的变化B.有电子转
下列关于化学理论学习和研究的说法错误的是( )A.化学键的变化不一定会引起化学反应的变化B.外界条
下列关于化学理论学习和研究的说法错误的是( )A.化学键的变化不一定会引起化学反应的变化B.外界条件改变一定会引起化学反应的快慢变化C.化学模型
下列各组物质中化学键类型和晶体类型都相同的是( )A.氯化钠和碳酸钠B.二氧化碳和二氧化硅C.碘和
下列各组物质中化学键类型和晶体类型都相同的是( )A.氯化钠和碳酸钠B.二氧化碳和二氧化硅C.碘和白磷D.铜和氧化铜
已知N4分子的结构和P4(白磷)分子的结构相似(正四面体) 断裂1mol N-N键吸收167kJ热量
已知N4分子的结构和P4(白磷)分子的结构相似(正四面体),断裂1mol N-N键吸收167kJ热量,生成1mol N≡N键放出942kJ热量。下列说法正确的是 [ ]A.N


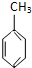 (g)+3H2(g)→
(g)+3H2(g)→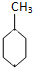 (g)的△H
(g)的△H









