甲醇是一种很好的清洁燃料 工业上用CH4和H2O为原料 通过反应Ⅰ和Ⅱ来制备甲醇。(1)将1.0 m
| 甲醇是一种很好的清洁燃料,工业上用CH4和H2O为原料,通过反应Ⅰ和Ⅱ来制备甲醇。 (1)将1.0 mol CH4和2.0 mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应: CH4(g)+H2O(g)  CO(g)+3H2(g)……Ⅰ CO(g)+3H2(g)……Ⅰ CH4的转化率与温度、压强的关系如下图。 |
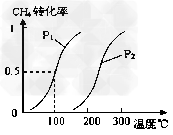 |
| ①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为___________ 。 ②图中的P1____________P2(填“”或“=”),100℃时平衡常数为__________ 。(填数值) ③该反应的△H _________ 0(填“”或“=”)。 (2)在压强为0.1 MPa条件下, 将a mol CO与 3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)  CH3OH(g);△H<0……Ⅱ。 CH3OH(g);△H<0……Ⅱ。若容器容积不变,下列措施可增加甲醇产率的是__________。 A.升高温度 B.将CH3OH(g)从体系中分离 C.充入He,使体系总压强增大 D.再充入1mol CO和3mol H2 (3)下列叙述正确的是①____________②___________ ①在盛有稀H2SO4的烧杯中放入用导线连接锌片和铜片. A.正极附近的SO42-离子浓度逐渐增大 B.电子通过导线由铜片流向锌片 C.正极有O2逸出 D.铜片上有H2逸出 ②E.电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的Cl2进入阳极室 F.电解精炼铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量小 G.工业上用电解熔融的AlCl3方法来制备金属Al H.电解熔融的烧碱绝对不可能得到金属钠 |
参考解答
| (1)①0.0030mol·L-1·min-1 ; ②< ; 2.25×10-4 ;③> (2)BD (3)① D ; ② F |
相似问题
用惰性电极电解一定质量的某浓度的NaCl溶液 一段时间后停止电解.此时若加入100g36.5%的浓盐
用惰性电极电解一定质量的某浓度的NaCl溶液,一段时间后停止电解.此时若加入100g36 5%的浓盐酸,所得溶液正好与原溶液完全相同,则下列说法正确的是(
甲醇(CH3OH)是一种重要的化工原料 广泛应用于化工生产 也可以直接用作燃料.已知: CH3OH(
甲醇(CH3OH)是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料.已知: CH3OH(l)+O2(g)===CO(g)+2H2O(g) ΔH1=-443 64kJ mol 2CO(g)
将铝制品与铁棒作电极 以NaHCO3溶液作电解液进行电解 通电后在铝制品与电解液的接触面上逐渐形成一
将铝制品与铁棒作电极,以NaHCO3溶液作电解液进行电解,通电后在铝制品与电解液的接触面上逐渐形成一层Al(OH)3薄膜,薄膜的某些部位存在着小孔,电解液
用惰性电极分别电解下列各物质的水溶液一段时间后 向剩余溶液中加入适量水能使溶液恢复到电解前浓度的是(
用惰性电极分别电解下列各物质的水溶液一段时间后,向剩余溶液中加入适量水能使溶液恢复到电解前浓度的是( )A.CuSO4B.Na2SO4C.CuCl2D.NaCl
电解饱和食盐水 不能直接得到的物质是( )A.氢气B.氯气C.氢氧化钠D.氯化氢
电解饱和食盐水,不能直接得到的物质是( )A.氢气B.氯气C.氢氧化钠D.氯化氢












