分别用配合物的价键理论 晶体场理论和分子轨道理论解释[CO(CN)6]4-的氧化性。请帮忙给出正确答
分别用配合物的价键理论、晶体场理论和分子轨道理论解释[CO(CN)6]4-的氧化性。
请帮忙给出正确答案和分析,谢谢!
参考解答
正确答案:[Co(CN)64-的中心离子Co2+3d7配体CN-1σ22σ23σ24σ21π45σ22π0。 价键理论:中心离子空出两个3d轨道以d2sp3杂化轨道接受配体CN-提供的孤对电子形成σ型配键。一个d电子激发到5s上5s电子能量高易失去故[Co(CN)64-容易氧化。 晶体场理论:将配体CN-看作带负电的点电荷中心离子与配体静电相吸且Co2+的3d轨道在配体负电荷的影响下能级分裂。CN-是强场配体△o≈30000cm-1P=22500cm-1中心离子的d电子排布为t2g6eg1处于高能量的eg轨道上的电子容易失去因而容易氧化。 分子轨道理论:Co2+的9个价轨道分成两组a1g、t1u、eg为σ型轨道t2g为π型轨道。σ型轨道分别与配体的5σ型轨道对称性匹配形成6个成键的σ型轨道6个反键的σ型轨道。在6个成键轨道中填入配体提供的12个电子形成σ配键。配体2π空轨道可与中心离子的t2g型轨道形成反馈的兀型轨道。△o= P故Co2+的7个d电子分别填入
P故Co2+的7个d电子分别填入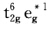 由于eg*能量高电子容易失去因而[Co(CN)64-容易氧化。 总之价键理论认为Co2+的3d7先激发成3d65s1然后失去5s电子;晶体场理论认为Co2+的3d7为t2g6eg1失去eg电子eg轨道是金属的d轨道;分子轨道理论认为Co2+的3d7在配合物中转化成处于主要含d轨道成分的分子轨道上即
由于eg*能量高电子容易失去因而[Co(CN)64-容易氧化。 总之价键理论认为Co2+的3d7先激发成3d65s1然后失去5s电子;晶体场理论认为Co2+的3d7为t2g6eg1失去eg电子eg轨道是金属的d轨道;分子轨道理论认为Co2+的3d7在配合物中转化成处于主要含d轨道成分的分子轨道上即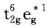 反键轨道eg*能量高容易失去。
反键轨道eg*能量高容易失去。
[Co(CN)64-的中心离子Co2+3d7,配体CN-1σ22σ23σ24σ21π45σ22π0。价键理论:中心离子空出两个3d轨道,以d2sp3杂化轨道接受配体CN-提供的孤对电子,形成σ型配键。一个d电子激发到5s上,5s电子能量高,易失去,故[Co(CN)64-容易氧化。晶体场理论:将配体CN-看作带负电的点电荷,中心离子与配体静电相吸,且Co2+的3d轨道在配体负电荷的影响下能级分裂。CN-是强场配体,△o≈30000cm-1,P=22500cm-1,中心离子的d电子排布为t2g6eg1,处于高能量的eg轨道上的电子容易失去,因而容易氧化。分子轨道理论:Co2+的9个价轨道分成两组,a1g、t1u、eg为σ型轨道,t2g为π型轨道。σ型轨道分别与配体的5σ型轨道对称性匹配,形成6个成键的σ型轨道,6个反键的σ型轨道。在6个成键轨道中填入配体提供的12个电子,形成σ配键。配体2π空轨道可与中心离子的t2g型轨道形成反馈的兀型轨道。△o=P,故Co2+的7个d电子分别填入,由于eg*能量高,电子容易失去,因而[Co(CN)64-容易氧化。总之,价键理论认为Co2+的3d7先激发成3d65s1,然后失去5s电子;晶体场理论认为Co2+的3d7为t2g6eg1,失去eg电子,eg轨道是金属的d轨道;分子轨道理论认为Co2+的3d7在配合物中转化成处于主要含d轨道成分的分子轨道上,即,反键轨道eg*能量高,容易失去。
相似问题
为什么铜氨溶液与硫酸铜溶液的颜色不同?请帮忙给出正确答案和分析 谢谢!
为什么铜氨溶液与硫酸铜溶液的颜色不同?请帮忙给出正确答案和分析,谢谢!
以z轴为键轴 按对称性匹配原则 下列各对原子轨道能否组成分子轨道 若能 写出分子轨道的类型: ①s
以z轴为键轴,按对称性匹配原则,下列各对原子轨道能否组成分子轨道,若能,写出分子轨道的类型: ①s, ②dχy,dχy ③dyz,dyz ④dyz,dχz ⑤s
配合物[CO(H2O)4]Cl2具有两种几何异构体。若此配合物为正六角形构型 应当有几种异构体?若为
配合物[CO(H2O)4]Cl2具有两种几何异构体。若此配合物为正六角形构型,应当有几种异构体?若为三角柱形,又有几种异构体?那么[Co(H2O)4]Cl2应是什么构型?请
配合物①[Fe(H2O)6]3+ ②[Fe(H2O)6]2+ ③[FeF6]4+的d—d跃迁频率大小
配合物①[Fe(H2O)6]3+、②[Fe(H2O)6]2+、③[FeF6]4+的d—d跃迁频率大小的顺序如何?为什么?请帮忙给出正确答案和分析,谢谢!
C—H键中氢原子1s轨道与碳原子2s轨道之间的重叠积分为0.57 若取C—H为z轴 氢原子的1s轨道
C—H键中氢原子1s轨道与碳原子2s轨道之间的重叠积分为0.57,若取C—H为z轴,氢原子的1s轨道与碳原子的2Pz之间重叠积分为0.467,氢原子的1s轨道和碳的指












