在200mL含Mg2+ Al3+ NH4+ H+ Cl- 等离子的溶液中 逐滴加入5mol?L-1N
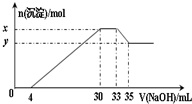
在200mL含Mg2+、Al3+、NH4+、H+、Cl- 等离子的溶液中,逐滴加入5mol?L-1NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示.下列叙述不正确的是( )
 |
参考解答
| A、由图及离子反应可知x-y的值即为Al(OH)3的物质的量, 则设Al(OH)3的物质的量为n, Al(OH)3+OH-═AlO2-+2H2O 1 1 n (35-33)×0.001L×5mol?L-1
解得n=0.01mol,即x-y=0.01mol,故A说法正确; B、由图可知,加入33mLNaOH溶液时Cl-离子以NaCl存在, 设Cl-离子的物质的量为z,由钠和氯原子守恒可知 NaOH~NaCl~Cl-, 1 1 33×0.001L×5mol?L-1 z
则原溶液中Cl-的物质的量浓度为
C、由图0~4mL时发生H++OH-═H2O, 则H+的物质的量为4mL×0.001L×5mol?L-1=0.02mol, H+的物质的量浓度为
D、由4mL~30mL发生Mg2+、Al3+结合OH-生成沉淀的反应, 则 Al3++3OH-═Al(OH)3↓ 1 3 1 0.01mol 0.03mol 0.01mol 设镁离子的物质的量为m, Mg2++2OH-═Mg(OH)2↓ 1 2 m (30-4)mL×0.001L×5mol?L-1-0.03mol
则原溶液中n(Mg2+):n(Al3+)=0.05:0.01=5:1,故D说法正确; 故选:B. |
相似问题
下列反应的离子方程式正确的是 [ ]A.甲醇 氧气组成的碱性燃料电池的负极反应:CH3OH+
下列反应的离子方程式正确的是 [ ]A.甲醇、氧气组成的碱性燃料电池的负极反应:CH3OH+H2O-6e-=CO2↑+6H+ B.在NaHSO4溶液中加Ba(OH)2至中性:H++SO42
列离子方程式书写正确的是( )A.铝粉加入稀硫酸中:Al+6H+=Al3++3H2↑B.乙酸和碳酸
列离子方程式书写正确的是( )A.铝粉加入稀硫酸中:Al+6H+=Al3++3H2↑B.乙酸和碳酸钠溶液的反应:2H++CO32-=CO2↑+H2OC.钠和水的反应:Na+H2O=Na+
离子方程式BaCO3+2H+===CO2↑+H2O+Ba2+中的H+不能代表的物质是[ ]①
离子方程式BaCO3+2H+===CO2↑+H2O+Ba2+中的H+不能代表的物质是[ ]①HCl ②H2SO4 ③HNO3 ④NaHSO4 ⑤CH3COOH A.①③B.①④⑤ C.②④⑤ D.①⑤
类推思维是化学解题中常用的一种思维方法 下列有关离子方程式的类推正确的是[ ]已知类推A.将
类推思维是化学解题中常用的一种思维方法,下列有关离子方程式的类推正确的是[ ]已知类推A 将Fe加入到CuSO4溶液中 Fe+Cu2+=Cu+Fe2+ 将Na加入到CuSO4溶
下列离子方程式书写正确的是[ ]A.向水玻璃中加入过量醋酸:2H++SiO32-=H2SiO
下列离子方程式书写正确的是[ ]A 向水玻璃中加入过量醋酸:2H++SiO32-=H2SiO3↓ B 硅酸钠溶液与澄清石灰水反应:SiO32-+Ca2+=CaSiO3↓ C 酸性条件下KI












