现有六种元素A B C D E均为周期表中前18号元素 且原子序数依次增大.已知A和B是形成化合物种
| 现有六种元素A、B、C、D、E均为周期表中前18号元素,且原子序数依次增大.已知A和B是形成化合物种类最多的两种元素;B元素和C元素通常形成电子数为14或22的化合物.D元素的原子半径是短周期主族元素中最大的;E元素是地壳中含量最高的金属.请回答以下问题: (1)请画出D的离子结构示意图______;由C、A两种元素形成的18电子化合物的电子式为______; (2)E的最高价氧化物与D的最高价氧化物的水化物反应的离子方程式:______; (3)由以上五种元素两两组合所形成的化合物中,既含有离子键又含有非极性共价键的常见化合物有______(填化学式);它的主要用途是______,它与水反应的离子方程式______. |
参考解答
| A和B是形成化合物种类最多的两种元素,应为H和C两种元素,所形成的化合物多为有机物,种类繁多,B元素和C元素通常形成电子数为14或22的化合物,这两种化合物分别 为CO、CO2,则可推知A为H元素,B为C元素,C为O元素,D元素的原子半径是短周期主族元素中最大的,应为Na元素,E元素是地壳中含量最高的金属,为Al元素, (1)D元素的原子半径是短周期主族元素中最大的,应为Na元素,Na+离子有11个质子,核外有10个电子,其离子结构示意图为 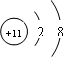 ,由C、A两种元素形成的18电子化合物为H2O2,为共价化合物,氧原子之间有一个共用电子对,满足8电子稳定结构,电子式为 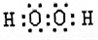 ,故答案为: 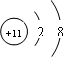 ; 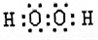 ; (2)该反应为Al2O3和NaOH之间的反应,Al2O3具有两性,与NaOH反应生成盐和水,反应的离子方程式为Al2O3+2OH-=2AlO-2+H2O, 故答案为:Al2O3+2OH-=2AlO-2+H2O; (3)Na2O2既含有离子键又含有非极性共价键,具有强氧化性,与水反应生成氧气,常用于供氧剂和漂白剂,与水反应的离子方程式为 2Na2O2+2H2O=4Na++4OH-+O2↑, 故答案为:Na2O2;供氧剂、漂白剂;2Na2O2+2H2O=4Na++4OH-+O2↑. |
相似问题
化工生产中常常用到“三酸两碱” “三酸”指硝酸 硫酸和盐酸 “两碱”指烧碱和纯碱.(1)从物质的分类
化工生产中常常用到“三酸两碱”,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱.(1)从物质的分类角度看,不恰当的一种物质是______.(2)“三
下表中评价合理的是( )选项 化学反应及其离子方程式 评价AFe3O4与稀硝酸反应:
下表中评价合理的是( )选项化学反应及其离子方程式评价AFe3O4与稀硝酸反应:2Fe3O4+18H+=6Fe3++H2↑+8H2O正确B向碳酸镁中加入稀盐酸:CO32-+2H+═CO
下列电离方程式错误的是( )A.AlCl3=Al3++3Cl-B.Na2CO3=2Na++CO32
下列电离方程式错误的是( )A.AlCl3=Al3++3Cl-B.Na2CO3=2Na++CO32-C.Ba(OH)2=Ba2++2OH-D.CH3CH2OH(乙醇)=CH3CH2O-+H+
(1)有以下物质:A 熔融氯化钠 B 盐酸 C 纯醋酸 D 碳酸钙 E 酒精 F 二氧化
(1)有以下物质:A、熔融氯化钠B、盐酸C、纯醋酸D、碳酸钙E、酒精F、二氧化碳G、氧化钠固体H、铜I、碳酸氢钠固体J、氢氧化钡溶液K、蔗糖①以上物质中,
下列反应的离子方程式正确的是( )A.硫酸铜溶液与氢氧化钡溶液反应:Cu2++2OH-=Cu(OH
下列反应的离子方程式正确的是( )A.硫酸铜溶液与氢氧化钡溶液反应:Cu2++2OH-=Cu(OH)2↓B.澄清石灰水跟盐酸反应:H++OH-=H2OC.碳酸钡溶于醋酸












