A B C D E 5种元素 A元素所处的周期数 主族序数 原子序数均相等;B是地壳中含量最多的元素
| A、B、C、D、E 5种元素,A元素所处的周期数、主族序数、原子序数均相等;B是地壳中含量最多的元素;C元素原子的最外层电子数比次外层少2个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成离子化合物D2C.E的单质既能与强酸反应,又能与强碱反应放出氢气. (1)B在周期表中的位置:第______周期,第______族. (2)C的气态氢化物的电子式______. (3)D的最高价氧化物的水化物与E单质反应的离子方程式 ______. (4)写出由这五种元素形成的某盐晶体化学式______,它在日常生活中的作用是______. (5)在①A2B、②D2B、③DBA、④B2、⑤DACB4、⑥D2C这6种物质中,只含共价键的是______;只含离子键的是______;既含共价键又含离子键的是______(均填数字序号). |
参考解答
| A元素所处的周期数、主族序数、原子序数均相等,应为H元素;B是地壳中含量最多的元素,应为O元素;C元素原子的最外层电子数比次外层少2个,应为S元素;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成离子化合物D2C,说明D为第四周期ⅠA族元素,为K元素,E的单质既能与强酸反应,又能与强碱反应放出氢气,应为Al元素, (1)B是地壳中含量最多的元素,应为O元素,位于第二周期第ⅥA族,故答案为:二,ⅥA; (2)C元素原子的最外层电子数比次外层少2个,应为S元素,对应的氢化物为H2S,为共价化合物,电子式为 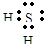 ,故答案为: 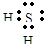 ; (3)D为第四周期ⅠA族元素,为K元素,对应的最高价氧化物的水化物为KOH,与Al反应生成偏铝酸钾和氢气,反应的离子方程式为2Al+2OH-+2e-=2AlO2-+3H2↑, 故答案为:2Al+2OH-+2e-=2AlO2-+3H2↑; (4)这五种元素分别为:H、O、Al、S、K等元素,组成的化合物为KAl(SO4)2?12H2O,常用作净水剂, 故答案为:KAl(SO4)2?12H2O;净水剂; (5)在①A2B、②D2B、③DBA、④B2、⑤DACB4、⑥D2C这6种物质中,其对应的物质分别是①H2O、②K2O、③KOH、④O2、⑤KHSO4、⑥K2S, 其中只含共价键的是H2O、O2;只含离子键的是K2O、K2S;既含共价键又含离子键的是KOH、KHSO4. 故答案为:①④;②⑥;③⑤. |
相似问题
将氢氧化钠溶液滴入Ca(HCO3)2溶液中 可能发生反应的离子方程式为( )A.H++OH-→H2
将氢氧化钠溶液滴入Ca(HCO3)2溶液中,可能发生反应的离子方程式为( )A.H++OH-→H2OB.HCO3-+Ca2++OH-═CaCO3↓+H2OC.HCO3-+OH-→CO32-+H2OD.2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32-
某学生设计了如下实验方法分离NaCl和CaCl2两种固体混合物.(1)B溶液是______ 加入过量
某学生设计了如下实验方法分离NaCl和CaCl2两种固体混合物.(1)B溶液是______,加入过量B溶液的原因是______,反应的离子方程式是______.(2)经此实验
海水中含有非常丰富的化学资源 从海水中可提取多种化工原料.下图是某化工厂对海水资源综合利用的示意图.
海水中含有非常丰富的化学资源,从海水中可提取多种化工原料.下图是某化工厂对海水资源综合利用的示意图.(注:母液中含有Mg2+)试回答下列问题:(1)
下列反应的离子方程式正确的是( )A.用惰性电极电解MgCl2溶液:2Cl-+2H2O═Cl2↑+
下列反应的离子方程式正确的是( )A.用惰性电极电解MgCl2溶液:2Cl-+2H2O═Cl2↑+H2↑+2OH-B.硫化钠发生水S2-+H2O=HS-+OH-C.少量小苏打溶液滴入Ba
下列离子方程式书写错误的是( )A.氢氧化钡溶液中加入硫酸溶液 Ba2++OH-+H++SO
下列离子方程式书写错误的是( )A.氢氧化钡溶液中加入硫酸溶液Ba2++OH-+H++SO42-=BaSO4↓+H2OB.氯化铜溶液中加入烧碱溶液Cu2++2OH-=Cu(OH)2↓C.












