某学习小组探究浓 稀硝酸氧化性的相对强弱的 按下图装置进行试验(夹持仪器已略去).实验表明浓硝酸能将
某学习小组探究浓、稀硝酸氧化性的相对强弱的,按下图装置进行试验(夹持仪器已略去).实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO.由此得出的结论是浓硝酸的氧化性强于稀硝酸.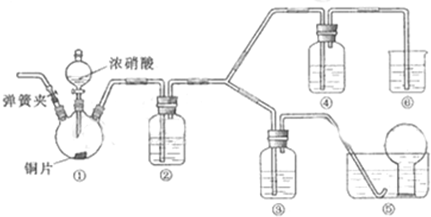 可选药品:浓硝酸、3mo/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳 已知:氢氧化钠溶液不与NO反应,能与NO2反应2NO2+2NaOH=NaNO3+NaNO2+H2O (1)实验应避免有害气体排放到空气中,装置③、④、⑥中盛放的药品依次是______ (2)滴加浓硝酸之前先检验装置的气密性,再加入药品;打开弹簧夹后______ (3)装置①中发生反应的化学方程式是______ (4)装置②的作用是______,发生反应的化学方程式是______ (5)该小组得出的结论依据的试验现象是______. |
参考解答
| (1)根据装置特点和实验目的,装置⑤是收集NO,装置⑥中盛放NaOH溶液吸收NO2防止污染大气;因为要验证稀HNO3不能氧化NO,所以装置③中应该盛放稀硝酸. 故答案为:3mol/L稀硝酸、浓硝酸、氢氧化钠溶液; (2)由于装置中残存的空气能氧化NO而对实验产生干扰,所以滴加浓HNO3之前需要通入一段时间CO2赶走装置中的空气,同时也需将装置⑤中导管末端伸入倒置的烧瓶内防止反应产生的NO气体逸出. 故答案为:通入CO2一段时间,关闭弹簧夹,将装置⑤中导管末端伸入倒置的烧瓶内; (3)Cu与浓HNO3反应生成Cu(NO3)2、NO2、H2O,反应为Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O, 故答案为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O; (4)装置②中盛放H2O,使NO2与H2O反应生成NO:3NO2+H2O=2HNO3+NO,故答案为:将NO2转化为NO;3NO2+H2O=2HNO3+NO; (5)NO通过稀HNO3溶液后,若无红棕色NO2产生,说明稀HNO3不能氧化NO,所以盛放稀HNO3装置的液面上方没有颜色变化即可说明之.装置④中盛放的是浓HNO3,若浓HNO3能氧化NO则装置④液面的上方会产生红棕色气体, 故答案为:装置③中液面上方气体仍为无色,装置④中液面上方气体由无色变为红棕色. |
相似问题
根据下列反应:(1)2Fe3++2I-=2Fe2++I2 (2)Br2+2Fe2+=2Br-+2Fe
根据下列反应:(1)2Fe3++2I-=2Fe2++I2(2)Br2+2Fe2+=2Br-+2Fe3+,判断离子的还原性由强到弱的顺序是( )A.Br->I->Fe2+B.I->Fe2+>Br-C.Fe2+>I->Br-D.Br->Fe2+>I-
下列叙述正确的是( )A.发生化学反应时失去电子越多的金属原子 还原能力越强B.金属阳离子被还原后
下列叙述正确的是( )A.发生化学反应时失去电子越多的金属原子,还原能力越强B.金属阳离子被还原后,一定得到该元素的单质C.某物质只含一种元素,
有下列氧化还原反应:①Fe+CuSO4═Cu+FeSO4 ②Cu+2FeCl3═CuCl2+2FeC
有下列氧化还原反应:①Fe+CuSO4═Cu+FeSO4 ②Cu+2FeCl3═CuCl2+2FeCl2③2FeCl2+Cl2═2FeCl3根据上述反应可判断各粒子氧化性由强到弱的顺序正确的是(
有反应①2H2O+Cl2+SO2=H2SO4+2HCl ②2KMnO4+16HCl(浓)=2KCl+
有反应①2H2O+Cl2+SO2=H2SO4+2HCl,②2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,针对上述两 个反应回答:(1)氧化剂的氧化性强弱顺序为KMnO4______(填
氧化还原反应是一类重要的化学反应 广泛存在于自然界中 对人们的生产 生活有着十分重要的作用。你认为下
氧化还原反应是一类重要的化学反应,广泛存在于自然界中,对人们的生产、生活有着十分重要的作用。你认为下列对氧化还原反应的描述不正确的是 [ ]A.肯












