溴及其化合物广泛应用在有机合成 化学分析等领域。(1)海水提溴过程中溴元素的变化如下:①过程Ⅰ 海水
| 溴及其化合物广泛应用在有机合成、化学分析等领域。 (1)海水提溴过程中溴元素的变化如下: 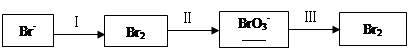 ①过程Ⅰ,海水显碱性,调其pH<3.5后,再通入氯气。 ⅰ.通入氯气后,反应的离子方程式是______。 ⅱ.调海水pH可提高Cl2的利用率,用平衡原理解释其原因是______。 ②过程Ⅱ,用热空气将溴赶出,再用浓碳酸钠溶液吸收。完成并配平下列方程式。 Br2+  Na2CO3= Na2CO3= NaBrO3+ NaBrO3+ CO2+ CO2+ ______ ______ ③过程Ⅲ,用硫酸酸化可得Br2和Na2SO4的混合溶液。 相同条件下,若用盐酸酸化,则所得溴的质量减少,原因是______。 (2)NaBrO3是一种分析试剂。向硫酸酸化的NaI溶液中逐滴加入NaBrO3溶液,当加入2.6 mol NaBrO3时,测得反应后溶液中溴和碘的存在形式及物质的量分别为:
|
参考解答
| (1)①ⅰ.Cl2+2Br-=Br2+2Cl- ⅱ.Cl2+H2O 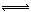 H++Cl-+HClO, 增大c(H+),平衡逆向移动,抑制Cl2与水反应 H++Cl-+HClO, 增大c(H+),平衡逆向移动,抑制Cl2与水反应②3 3 1 3 5 NaBr ③盐酸有还原性,与溴酸根反应 (2)3 |
试题分析:(1)①ⅰ.通入氯气后,Cl2与Br ̄反应:Cl2+2Br-=Br2+2Cl- ⅱ.Cl2与水的反应为可逆反应:Cl2+H2O 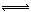 H++Cl-+HClO,降低溶液的pH,增大c(H+),平衡逆向移动,抑制Cl2与水反应。 H++Cl-+HClO,降低溶液的pH,增大c(H+),平衡逆向移动,抑制Cl2与水反应。②根据化合价的变化和元素守恒可推知生成物为NaBr,有化合价升降法可配平化学方程式。 ③HCl中Cl元素为-1价,为最低价态,所以盐酸具有还原性,能被溴酸根氧化,所溴的质量减少。 (2)根据氧化还原反应中得失电子数相等,可得5×2.6mol=2×0.5mol+6×n(IO3 ̄),则n(IO3 ̄)=2mol,根据元素守恒,原溶液中n(NaI)=0.5mol×2+2mol=3mol。 |
相似问题
下列反应的离子方程式 正确的是( )。A.碳酸氢钠和烧碱溶液:HCO3-+OH-=CO32-
下列反应的离子方程式,正确的是( )。A.碳酸氢钠和烧碱溶液:HCO3-+OH-=CO32-+H2OB.石灰水中通入过量的CO2: CO2+Ca2++2OH-=CaCO3↓+H2OC.稀硫
下列离子方程式正确的是( )A.铁溶于足量的稀硝酸 溶液变黄:3Fe+8H++2NO3-= 3F
下列离子方程式正确的是()A.铁溶于足量的稀硝酸,溶液变黄:3Fe+8H++2NO3-= 3Fe2++2NO↑+4H2OB.NaHSO4溶液与NaOH溶液混合:OH-+H+= H2OC
离子方程式BaCO3 + 2H+ = CO2↑ + H2O + Ba2+ 中的H+不能代表的物质是(
离子方程式BaCO3 + 2H+ = CO2↑ + H2O + Ba2+ 中的H+不能代表的物质是()①HCl;②H2SO4;③HNO3;④NaHSO4;⑤CH3COOHA.①③B.①④⑤C.②④⑤D.①⑤
下列表示对应化学反应的离子方程式正确的是A.向H2O中投入少量Na218O2固体:2H2O+2Na2
下列表示对应化学反应的离子方程式正确的是A.向H2O中投入少量Na218O2固体:2H2O+2Na218O2=4Na++418OH-+O2↑B.Fe3O4与稀硝酸反应:Fe3O4+8H+=2Fe3++Fe
下列离子方程式表达正确的是( )A.氢氧化铁溶于氢碘酸:Fe(OH)3+3H+Fe3++3H2OB
下列离子方程式表达正确的是( )A.氢氧化铁溶于氢碘酸:Fe(OH)3+3H+Fe3++3H2OB.小苏打溶液呈碱性的原因:HC+H2OH3O++CC.稀硝酸中加入足量的铁屑:3Fe+8












