某溶液中含有大量的Cl一 Br一 I一 若向l L该混合溶液中通入一定量的Cl2 溶液中Cl- Br
某溶液中含有大量的Cl一、Br一、I一,若向l L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br一、I一的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,原溶液中Cl一、Br一、I一的物质的量浓度之比为( )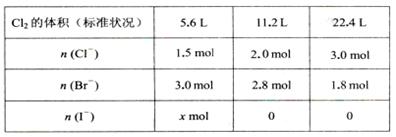
|
参考解答
| A |
试题分析:通入氯气先发生反应Cl2 +2I一 = I2 +2Cl一 ,当I一 完全被氧化后发生反应Cl2 +2 Br一= Br2 +2Cl一 ,所以从反应方程式可以看出,反应一个I一、Br一 则生成一个Cl一 ,所以根据规律对比表格中前两组数据可以看出,通入11.2L氯气时,Cl一 增加0.5mol,Br一 消耗0.2mol,则同时消耗I一 0.3mol所以X为0.3,所以开始通入的5.6L氯气全部用于氧化I一 ,氧化I一 0.5mol,生成Cl一 0.5mol,所以可知开始时Cl一、Br一、I一 的物质的量分别为1.0mol、3.0mol、0.8mol,所以物质的量之比为5:15:4。故选A。 |
相似问题
根据下面两个化学方程式判断Fe2+ Cu2+ Fe3+氧化性由强到弱的顺序是( )2FeCl3+C
根据下面两个化学方程式判断Fe2+、Cu2+、Fe3+氧化性由强到弱的顺序是( )2FeCl3+Cu=2FeCl2+CuCl2,CuCl2+Fe=FeCl2+Cu.A.Fe3+>Fe2+>Cu2+B.Fe3+>
已知 2Fe3+ +2I- =2Fe2+ +I2 2Fe2+ +Cl2=2Fe3+ +2Cl-
已知 2Fe3+ +2I- =2Fe2+ +I2,2Fe2+ +Cl2=2Fe3+ +2Cl- 则有关离子的还原性由强到弱的顺序为()A.Cl- > Fe2+ > I- B.I- >
已知I- Fe2+ SO2 Cl- 和H2O2均有还原性 它们在酸性溶液中还原性的顺序为SO2>I-
已知I-、Fe2+、SO2、Cl-、和H2O2均有还原性,它们在酸性溶液中还原性的顺序为SO2>I->Fe2+>H2O2>Cl-,则下列反应不可能发生的是A.2Fe 3+ + SO2 +
溶液中可发生以下反应:①16H++10Z+2XO=2X+5Z2+8H2O ②2M+R2=2M+2R-
溶液中可发生以下反应:①16H++10Z+2XO=2X+5Z2+8H2O,②2M+R2=2M+2R-,③2R-+Z2=R2+2Z-由此判断下列说法错误的是A.氧化性强弱:<Z2 <R
已知SO32-+I2+H2O=SO42-+2I-+2H+.某溶液中可能含有I- NH4+ Cu2+
已知SO32-+I2+H2O=SO42-+2I-+2H+.某溶液中可能含有I-、NH4+、Cu2+、SO32-,向该无色溶液中加入少量溴水,溶液仍呈无色.则下列关于该溶液组成的判断正确












