(13分)[化学——物质结构与性质]由Cu N B等元素组成的新型材料有着广泛用途。(1)基态 Cu
| (13分)[化学——物质结构与性质]由Cu、N、B等元素组成的新型材料有着广泛用途。 (1)基态 Cu+ 的核外电子排布式为 。在高温下CuO 能分解生成Cu2O,试从原子结构角度解释其原因: 。 (2)立方氮化硼是一种新型的超硬、耐磨、耐高温的结构材料,它属于 晶体。 (3)化合物A (H3BNH3) 是一种潜在的储氢材料,它可由六元环状化合物 (HB=NH)3通过3CH4 + 2 (HB=NH)3 + 6H2O →3CO2 + 6H3BNH3 制得。 ①与上述化学方程式有关的叙述不正确的是 。(填标号)
(4)在硼酸盐中,阴离子有链状、环状等多种结构形式。图(a)是一种链状结构的多硼酸根,则多硼酸根离子符号为 。图(b)是硼砂晶体中阴离子的环状结构,其中硼原子采取的杂化类型为 。 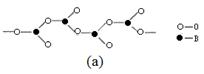 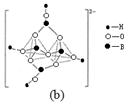 |
参考解答
| (1) [Ar3d10 ;结构上Cu2+为3d9,而Cu+为3d10全充满更稳定 (2) 原子晶体 (3) ① A ②12 (4) [BO2nn-(或BO2-);sp2、sp3 |
试题分析:(1)Cu是29号元素。基态 Cu+ 的核外有28个电子。核外电子排布式为[Ar3d10 ;在高温下CuO 能分解生成Cu2O,是因为CuO在变为Cu2O时,其中的Cu的结构由Cu2+的3d9变为3d10的全充满Cu+。更稳定的结构。(2)立方氮化硼是一种新型的超硬、耐磨、耐高温的结构材料,它属于原子晶体。(3)①A. 在反应前后CH4中的碳原子的轨道杂化类型是sp3杂化,在反应后CO2中的碳原子的轨道杂化类型是sp杂化。轨道杂化类型改变。错误。B. CH4、H2O、CO2分子空间构型分别是:正四面体形、V形、直线形。正确。C. 一般情况下,同一周期的元素,元素的非金属性越强,原子半径越小,第一电离能越大。但是由于N原子的核外电子是处于半充满的稳定状态,所以其第一电离能比O盐酸的还大。因此第一电离能大小关系是:N>O>C>B。正确。D. 在化合物A中的N原子上存在配位键。正确。②由H3BNH3的分子结构可知在1个(HB=NH)3分子中有12个σ键.(4)由图(a)可知多硼酸根离子符号为BO2-或[BO2nn-。由图(b)硼砂晶体可知:其中硼原子采取的杂化类型sp2、sp3 两种类型。 |
相似问题
运用元素周期律分析下面推断 其中错误的是( )A.铍(Be)的氧化物的水化物可能具有两性B.砹
运用元素周期律分析下面推断,其中错误的是()A.铍(Be)的氧化物的水化物可能具有两性B.砹(At)为有色固体,HAt不稳定,AgAt感光性很强,但不溶于水也不
下列关于元素周期表和元素周期律的说法错误的是A.Li Na K元素的原子核外电子层数随着核电荷数的增
下列关于元素周期表和元素周期律的说法错误的是A.Li、Na、K元素的原子核外电子层数随着核电荷数的增加而增多B.第二周期元素从Li到F,非金属性逐渐增强C
下列叙述正确的是 ( )A.同周期元素中 VII A族元素的原子半径最大B.现已发现的零族元素的
下列叙述正确的是 ( )A.同周期元素中,VII A族元素的原子半径最大B.现已发现的零族元素的单质在常温常压下都是气体C.VI A族元素的原子,其半径越
有A B C D E五种短周期元素 已知相邻的A B C D四种元素原子核外共有56个电子 在周期表
有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的单质可与酸反应,1 mol E单质与足量
短周期元素X Y Z W在元素周期表中的相对位置如图所示 其中W原子的最外层电子数是最内层电子数的3
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍。下列判断正确的是()A.原子半径:rW>rZ>rY>












