( 13分)下面的表格是元素周期表的一部分 其中的字母对应不同的元素。A MQR E
( 13分)下面的表格是元素周期表的一部分,其中的字母对应不同的元素。
(1)G和J形成的合金是一种贮氢材料,其晶体结构与氯化铯相同。该合金中每个G原子周围与其最近且等距的J原子有 个。该晶体属于 晶体 A .离子晶体 B . 原子晶体 C . 分子晶体 D. 金属晶体 (2)M3R2是一种直线型分子R=M=M=M=R,该分子是一种 分子(填极性或非极性)。 (3)请写出D-的电子排布式: 。 (4)M2A2也是直线型分子,1个分子中含有 个σ键。 (5)化合物E2D6分子中各原子均达到了八电子稳定结构,请画出其结构式。(用元素符号表示) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
参考解答
| (1)8 D (2)非极性 (3)1s22s22p63s23p6 (4)3 (5) 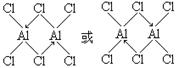 |
试题分析:根据元素在周期表中是位置可知:A是H;M是C;Q是N;R是O;E是Al;D是Cl;G是Ti;J是Fe。(1)Ti和Fe形成的合金是一种贮氢材料,其晶体结构与氯化铯相同。因为在氯化铯晶体中,每个Cs+离子周围与其距离相等且最近的Cl-有8个。使用该合金中每个G原子周围与其最近且等距的J原子有8个。该晶体是合金,属于金属晶体。选项为D。(2)C3O2是一种直线型分子O=C=C=C=O,。由于该分子的空间排列是对称的。所以该分子是一种非极性分子。(3)在Cl-的核外有18个电子。其电子排布式:1s22s22p63s23p6。(4)C2H2也是直线型分子,1个分子中含有3个σ键。(5)在化合物Al2Cl6分子中各原子均达到了八电子稳定结构,其结构式是 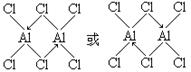 。 。 |
相似问题
第三周期第ⅡA ⅢA族金属元素的原子失去电子后 生成的阳离子的电子层结构( )。A.与它同周期稀有
第三周期第ⅡA、ⅢA族金属元素的原子失去电子后,生成的阳离子的电子层结构( )。A 与它同周期稀有气体元素原子的电子层结构相同B 与它上一周期稀有气体
(双选)关于碱金属单质的性质叙述错误的是( )。A.在空气中燃烧的生成物都是过氧化物B.与水反应都
(双选)关于碱金属单质的性质叙述错误的是( )。A.在空气中燃烧的生成物都是过氧化物B.与水反应都能生成碱和氢气C.熔、沸点随原子序数增加而升高D.
元素在周围表中的位置 反映了元素的原子结构和元素的性质 下列说法正确的是( )A.同一元素不可能
元素在周围表中的位置,反映了元素的原子结构和元素的性质,下列说法正确的是()A.同一元素不可能既表现金属性,又表现非金属性 B.第三周期主族元素
下列物质性质的递变关系正确的是 A.原子半径:C>Al>Na>KB.碱性:NaOH>KOH>Ca(O
下列物质性质的递变关系正确的是 A.原子半径:C>Al>Na>KB.碱性:NaOH>KOH>Ca(OH)2>Mg(OH)2C.离子半径:O2->F->Al3+>Mg2+>Na+D.最高价:Cl>Si>Al>F
下列事实不能作为实验判断依据的是( )A.钠和镁分别与冷水反应 判断钠和镁的金属活动性强弱B.在M
下列事实不能作为实验判断依据的是()A.钠和镁分别与冷水反应,判断钠和镁的金属活动性强弱B.在MgCl2与AlCl3溶液中分别加入过量的氨水,判断镁与铝的












