现有A B C D四种短周期主族元素 A元素形成的—2价阴离子比氦原子的核外电子数多8个 B元素与A
| 现有A、B、C、D四种短周期主族元素,A元素形成的—2价阴离子比氦原子的核外电子数多8个,B元素与A元素形成的一种化合物为淡黄色固体,该固体遇到空气能生成A的单质;C为原子核内有12个中子的金属元素,当2.4克C与足量热水反应时,在标准状况下放出气体2.24L,C形成正二价阳离子;D元素原子的M层上有7个电子。 (1)写出B、C两种元素的元素符号:B ,C ; (2)画出A2-的离子结构示意图: , 指出D在周期表的位置: ; (3)写出B的呈淡黄色的化合物与CO2反应的化学方程式: ; (4)比较D的气态氢化物与H2S和HF的稳定性由强到弱的顺序: (用化学式表示)。 |
参考解答
| (1)Na;Mg (2) 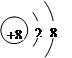 ;第三周期第ⅦA族 ;第三周期第ⅦA族(3)2Na2O2+2CO2=2Na2CO3+O2 (4)HF > HCl > H2S |
试题分析:现有A、B、C、D四种元素,A元素形成的-2价阴离子比氦原子的核外电子数多8个,则A为氧元素;B元素与O元素形成的一种化合物为淡黄色固体,该固体遇到空气能生成氧气,淡黄色固体为过氧化钠,则B为钠元素;C为原子核内有12个中子的金属元素,当2.4g C与足量热水反应时,在标准状况下放出气体2.24L,C形成正二价阳离子,令C的摩尔质量为xg/mol,则 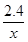 ×2= ×2=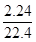 ×2,解得x=24,所以C是质子数为24-12=12,故C为镁元素;D元素原子的M层上有7个电子,则D为氯元素,则 ×2,解得x=24,所以C是质子数为24-12=12,故C为镁元素;D元素原子的M层上有7个电子,则D为氯元素,则(1)由上述分析可知,B为Na、C为Mg,故答案为:Na;Mg; (2)O2-的质子数为8,核外电子数为10,则离子结构示意图为 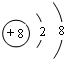 ,D为氯元素,原子核外有17个电子,有3个电子层,最外层有7个电子,处于第三周期第ⅦA族,故答案为: ,D为氯元素,原子核外有17个电子,有3个电子层,最外层有7个电子,处于第三周期第ⅦA族,故答案为: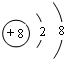 ;第三周期第ⅦA族; ;第三周期第ⅦA族;(3)过氧化钠与二氧化碳反应生成碳酸钠与氧气,反应方程式为:2Na2O2+2CO2=2Na2CO3+O2,故答案为:2Na2O2+2CO2=2Na2CO3+O2; (4)D的气态氢化物为HCl,非金属性F>Cl>S,则气态氢化物的稳定性为HF>HCl>H2S,故答案为:HF>HCl>H2S。 |
相似问题
下列物质的沸点逐渐升高的是 A.NH3 PH3 AsH3 SbH3 B.Si SiC H2O CO
下列物质的沸点逐渐升高的是 A.NH3 PH3 AsH3 SbH3 B.Si SiC H2O CO2C.NaI NaBr NaCl NaF D.Li Na K Rb
以下能级符号错误的是A.5sB.3dC.3fD.6p
以下能级符号错误的是A.5sB.3dC.3fD.6p
下表是部分短周期元素的原子半径及主要化合价 以下叙述正确的是( )元素代号LMQRT原子半径0.1
下表是部分短周期元素的原子半径及主要化合价,以下叙述正确的是()元素代号LMQRT原子半径0 160 nm0 143 nm0 112 nm0 104 nm0 066 nm主要化合价+2
有X Y两种原子 X原子的M电子层比Y原子的M电子层少3个电子 Y原子的L电子层的电子数恰为X原子的
有X,Y两种原子,X原子的M电子层比Y原子的M电子层少3个电子,Y原子的L电子层的电子数恰为X原子的L层电子数的2倍,则X,Y元素的元素符号分别为A.Mg和SB.
短周期元素X Y Z W Q的原子序数依次增大 且只有一种金属元素。其中X与W处于同一主族 Z元素原
短周期元素X、Y、Z、W、Q的原子序数依次增大,且只有一种金属元素。其中X与W处于同一主族,Z元素原子半径在短周期中最大(稀有气体除外),W、Z之间与W、












