过氧化氢水溶液俗称双氧水 沸点比水高 遇光 热及重金属化合物等均能引起分解。(1)某试剂厂先制得7%
| 过氧化氢水溶液俗称双氧水,沸点比水高,遇光、热及重金属化合物等均能引起分解。 (1)某试剂厂先制得7%~8%的双氧水,欲将其浓缩成30%的溶液,适宜方法是 (填写编号)。 a.常压蒸馏 b.减压蒸馏 c.加入生石灰常压蒸馏 d.加压蒸馏 (2)如果得到的双氧水中氧元素的含量为90%,则过氧化氢的纯度为 。众所周知,氢气在空气中燃烧生成水。有人提出,氢气在空气中燃烧也可能生成H2O2,但它因高温而分解了。为了验证氢气在空气中燃烧的产物中是否含有H2O2,某课外小组同学设计的实验装置见图-1。 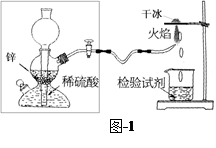 (3)甲同学想从下图-2的①-④中选取替代图-1方框中的装置,可行的是 (填写编号)。 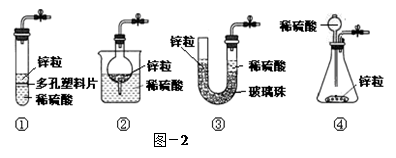 (4)若乙同学用酸性高锰酸钾溶液检测到了H2O2的存在,完成该反应的离子方程式: → + Mn2+ + H2O 丙同学对乙的检验方案提出了质疑:若锌粒与稀硫酸的反应中产生了少量H2S等还原性气体,也会使酸性高锰酸钾溶液褪色。请对乙同学的实验方案提出改进建议: 。 (5)过碳酸钠(2Na2CO3?3H2O2)俗称固体双氧水,极易分解,其分解反应的化学方程式可表示为:2 (2Na2CO3?3H2O2) → 4Na2CO3 + 6H2O + 3O2↑ 取一定量的过碳酸钠在密闭容器中使它完全分解,测得生成氧气12.0g。冷却到室温后,向所得产物中加水配制成10.6% 的Na2CO3溶液,需加水 g。 |
参考解答
| (1)b(2分) (2)21.25% (2分,写0.2125给全分) (3)②(2分) (4)2MnO4-+5H2O2+6H+→2Mn2++5O2↑+8H2O(2分,物质正确写全1分,配平1分); 先将制得的氢气通过装有碱石灰的干燥管,然后点燃。(合理,给分)(2分) (5)433.5g(2分) |
试题分析:(1)双氧水受热会分解,只有通过减压蒸馏降低温度后蒸出以防其分解; (2)双氧水中含氧的物质有:H2O2和H2O,设物质的量分别为x和y,则由双氧水中氧元素的含量为90%,则过氧化氢的纯度为表示为:16/90%='18y+34x' ,(2x+3y)*16/(34x+18y)=90%,化简得:2x+y=1,得x=9-8/0.9。求得34x/(34x+18y)=21.25%。 (3)图-1方框中的装置是启谱发生器装置,满足条件的是②,可以通过使固液分离从而使反应停止发生。 (4)根据氧化还原反应原理,可写出2MnO4-+5H2O2+6H+→2Mn2++5O2↑+8H2O。相当于验证氢气中是否含有H2S气体,可以把混合气体通入到硫酸铜溶液中若产生黑色沉淀,即有H2S气体。也可以先将制得的氢气通过装有碱石灰的干燥管,然后点燃。 (5)根据方程式2 (2Na2CO3?3H2O2) → 4Na2CO3 + 6H2O + 3O2↑,当生成生成氧气12.0g时,生成碳酸钠12*4*106/(3*32)=53g,生成水的质量为:(0.5*6/4)*18=13.5g。要配制成10.6% 的Na2CO3溶液,需加水(53/0.106 )-53-13.5=433.5g。 |
相似问题
a mol FeS与b mol Fe3O4投入到V L c mol·L-1的硝酸溶液中恰好完全反应
a mol FeS与b mol Fe3O4投入到V L c mol·L-1的硝酸溶液中恰好完全反应,假设只产生NO气体。所得澄清溶液的成分是Fe(NO3)3和H2SO4的混合液,则反
a mol FeS与b mol FeO投入V L c mol·L-1的稀硝酸溶液中充分反应 产生NO
a mol FeS与b mol FeO投入V L、c mol·L-1的稀硝酸溶液中充分反应,产生NO气体,所得澄清溶液的成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中
工业上常利用反应 3Cl2 + 6KOH(热) → KClO3 + 5KCl + 3H2O 制取KC
工业上常利用反应 3Cl2 + 6KOH(热) → KClO3 + 5KCl + 3H2O 制取KClO3(混有KClO)。实验室模拟上述制备:在含溶质14mol的KOH(aq,热)中通入一
磷是地壳中含量较为丰富的非金属元素 主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和
磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和化合物在工农业生产中有着重要的应用。(1)白磷(P4)可由C
下列说法正确的是( )A.常温常压下 22.4 L氯气与足量镁粉充分反应 转移的电子数为2NAB.
下列说法正确的是( )A.常温常压下,22 4 L氯气与足量镁粉充分反应,转移的电子数为2NAB.化合反应均为氧化还原反应C.电解NaCl溶液得到22 4 L H2(












