铜是重要的金属材料.(1)工业上可用Cu2S和O2反应制取粗铜 化学方程式为______该反应中氧化
| 铜是重要的金属材料. (1)工业上可用Cu2S和O2反应制取粗铜,化学方程式为______该反应中氧化剂为______. (2)在100mL 18mol-L-1 浓硫酸中加入过量的铜片,加热使之充分反应,反应中被还原的H2SO4<______mol. (3)电子工业曾用30%的FeCl3溶液腐蚀覆盖铜箔的绝缘板制印刷电路板,为了从使用过的废腐蚀液中回收铜,并重新得FeCl3溶液,设计如下实验流程. 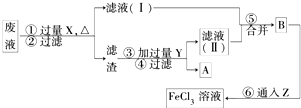 上述流程中,所加试剂的化学式为:X______,Y______,Z______; 第⑥步反应的离子方程式为______. |
参考解答
| (1)工业上可用Cu2S和O2反应制取粗铜,元素化合价铜元素化合价降低,硫XYZ元素化合价升高,氧气中氧元素化合价降低,说明亚铜被还原,硫元素被氧化,发生的氧化还原反应为Cu2S+O2═2Cu+SO2,该反应中氧化剂为O2、Cu2S,故答案为:Cu2S+O2═2Cu+SO2;O2、Cu2S; (2)在100mL 18mol?L-1 浓硫酸中加入过量的铜片,加热使之充分反应,若全部被铜还原物质的量为0.9mol,但随着反应进行,浓硫酸浓度减小,变为稀硫酸后不再和铜反应,所以还原的硫酸物质的量小于0.9mol,故答案为:0.9; (3)用30%的FeCl3溶液腐蚀覆盖铜箔的绝缘板制印刷电路板,废腐蚀液中含有铜离子和亚铁离子、三价铁离子,根据分离流程,先加入的x为铁,发生反应:2Fe3++Fe=3Fe2+、Cu2++Fe=Fe2++Cu;过滤得到亚铁离子的溶液和滤渣铁、铜;加入过量盐酸溶解铁后过滤得到铜,得到的氯化亚铁溶液中 通入氯气氧化亚铁离子为三价铁离子,重新得到氯化铁溶液;所以推断为:X为:Fe;Y为HCl;Z为Cl2;第⑥步反应的离子方程式为氯气氧化亚铁离子的反应为2Fe2++Cl2═2Fe3++2Cl-, 故答案为:Fe;HCl;Cl2;2Fe2++Cl2═2Fe3++2Cl-. |
相似问题
(1)写出有关反应的化学方程式:①工业用氯气与熟石灰制取漂白粉______.②钠的一种化合物用作呼吸
(1)写出有关反应的化学方程式:①工业用氯气与熟石灰制取漂白粉______.②钠的一种化合物用作呼吸面具中的供氧剂______.(2)科学家发现,食用虾类等
(1)①A图是“四种基本反应类型与氧化还原反应的关系”图 请在A图中用阴影部分表示反应:H2+CuO
(1)①A图是“四种基本反应类型与氧化还原反应的关系”图,请在A图中用阴影部分表示反应:H2+CuO═Cu+H2O所属的区域是______.②“四种基本反应类型与氧
2007年3月22日是第十五届“世界水日”.我国纪念“世界水日”和开展“中国水周”活动的宣传主题“水
2007年3月22日是第十五届“世界水日”.我国纪念“世界水日”和开展“中国水周”活动的宣传主题“水利发展与和谐社会”.下列有关水的化学反应中,水既不
下列图示关系不正确的是( )A.B.C.D.
下列图示关系不正确的是( )A.B.C.D.
下列叙述中 正确的是( )A.氧化还原反应的实质是化合价的变化B.具有氧化性的物质在反应中一定做氧
下列叙述中,正确的是( )A.氧化还原反应的实质是化合价的变化B.具有氧化性的物质在反应中一定做氧化剂C.氧化剂氧化其他物质时,本身被还原D.化












