(14分)现向含6 mol KI的硫酸溶液中逐滴加入KBrO3溶液 整个过程中含碘物质的物质的量与所
(14分)现向含6 mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加人KBrO3的物质的量的关系如图所示。请回答下列问题: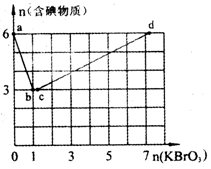 (1)b点时,KI反应完全,则氧化产物与还原产物的物 质的量之比为____,电子转移数目为 。 (2)已知b→c过程中,仅有溴元素发生化合价变化,写出并配平该反应的离子方程式 。 (3)已知在c→d段发生下列反应: 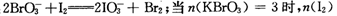 = mol,再向溶液中通入足量乙烯,充分反应后溶液增加的质量为 g。 = mol,再向溶液中通入足量乙烯,充分反应后溶液增加的质量为 g。(4)含a mol KI的硫酸溶液所能消耗n(KBrO3)的最大值为____。整个过程中转移的电子数目为____。 |
参考解答
| (14)(1)3:1;(2分)6NA(或6×6.02×1023);(2分). (2)BrO3-+ 5Br- + 6H+ =3Br2 + 3H2O;(2分) (3)2.1(2分);100.8(2分) (4)1.2a(2分) 6aNA(2分) |
| 本题考察了氧化还原反应知识在图表中的综合分析能力。(1)在b点时,纵坐标的含碘物质从6mol到3mol,应该是有I2生成,即发生BrO3-+ 6I- + 6H+ =3I2 + 3H2O + Br-。(2)b→c过程中纵坐标的含碘物质不变,则I2未反应,应该为生成的Br-反应。(3)c点前,横坐标消耗KBrO31.2mol,当n(KBrO3)=3mol时,c→d段则消耗KBrO31.8mol。(4)综合三阶段反应,a mol KI最多消耗1.2 a mol KBrO3,最后产物为Br2、IO3-,所以转移电子数目为6a mol。 |
相似问题
关于反应: 4Al+3TiO2+3C=2Al2O3+3TiC的叙述中正确的是A.Al是还原剂 TiC
关于反应: 4Al+3TiO2+3C=2Al2O3+3TiC的叙述中正确的是A.Al是还原剂,TiC是氧化产物B.TiO2是氧化剂,TiC是还原产物C.反应中氧化剂与还原剂的物质的量
(2分)下列反应中 电子转移方向或数目不正确的是
(2分)下列反应中,电子转移方向或数目不正确的是
下列各反应过程中需加入还原剂才能实现的是A. S → SO2B. Cu→Cu2+C. Fe3+→Fe
下列各反应过程中需加入还原剂才能实现的是A. S → SO2B. Cu→Cu2+C. Fe3+→FeD. AgNO3→AgCl
已知:①向KMnO4固体中滴加浓盐酸 产生黄绿色气体(Cl2);②向FeCl2溶液中通入少量①产生的
已知:①向KMnO4固体中滴加浓盐酸,产生黄绿色气体(Cl2);②向FeCl2溶液中通入少量①产生的气体,溶液变为棕黄色;③取实验②生成的溶液滴在淀粉KI试纸上
L M Q R X代表五种物质 它们都含某种价态的氮元素 各物质中氮元素的化合价只有一种。物质L中氮
L、M、Q、R、X代表五种物质,它们都含某种价态的氮元素,各物质中氮元素的化合价只有一种。物质L中氮元素的化合价比物质M中氮元素的化合价低。在一定条件












