已知:KMnO4+HCl(浓)→KCl+MnCl2+Cl2↑+H2O(1)该反应中 氧化剂是:___
| 已知:KMnO4+HCl(浓)→KCl+MnCl2+Cl2↑+H2O (1)该反应中,氧化剂是:______,氧化产物是:______.(填化学式) (2)配平以上化学反应方程式,并用“双线桥法”标明反应中电子转移的方向和数目______. (3)表现还原性的HCl与参加反应的HCl的物质的量之比为______. (4)若有63.2g高锰酸钾参加反应,则转移电子的物质的量为______mol,产生的Cl2在标准状况下的体积为______L. (5)又已知MnO2+4HCl(浓)
|
参考解答
| (1)反应中Mn元素的化合价降低,Cl元素的化合价升高,则KMnO4为氧化剂,HCl为还原剂,Cl2为氧化产物,故答案为:KMnO4;Cl2; (2)Mn失去2×5e-,Cl得到2×5×e-,该反应为2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O,则用“双线桥法”标明反应中电子转移的方向和数目为 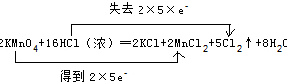 , ,故答案为: 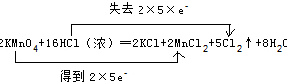 ; ;(3)由反应可知,生成氯气体现其还原性,生成盐体现其酸性,由Cl原子守恒可知则表现还原性的HCl与参加反应的HCl的物质的量之比为10:6=5:3, 故答案为:5:3; (4)有63.2g高锰酸钾参加反应,n(KMnO4)=
(5)由氧化剂的氧化性大于氧化产物的氧化性可知,氧化性为KMnO4>Cl2,MnO2>Cl2,结合反应条件可知,与二氧化锰反应需要加热,则氧化性为KMnO4>MnO2>Cl2, 故答案为:KMnO4>MnO2>Cl2. |
相似问题
实验室里利用以下反应制取少量氮气:NaNO2+NH4Cl═NaCl+N2↑+2H2O.关于该反应的下
实验室里利用以下反应制取少量氮气:NaNO2+NH4Cl═NaCl+N2↑+2H2O.关于该反应的下列说法错误的是( )A.NaNO2是氧化剂B.每生成1molN2转移的电子的
下列反应中 属于氧化还原反应的是( )A.Fe(OH)3+3HNO3═Fe(NO3)3+3H2OB
下列反应中,属于氧化还原反应的是( )A.Fe(OH)3+3HNO3═Fe(NO3)3+3H2OB.Ca(ClO)2+CO2+H2O═CaCO3+2HClOC.3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2OD.CaCO高温 CaO+CO2↑
(1)已知2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O 该反应中 氧化剂是
(1)已知2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O,该反应中,氧化剂是______,氧化产物是______.若生成氯气11 2L(标准状况),则转移电子的物质的量为
下列反应中 反应物中的各种元素都参加了氧化还原的是( )A.2KNO3+S+3C═K2S+N2↑+
下列反应中,反应物中的各种元素都参加了氧化还原的是( )A.2KNO3+S+3C═K2S+N2↑+3CO2↑B.2KMnO4═K2MnO4+MnO2+O2↑C.4HNO3═2H2O+4NO2↑+O2↑D.HgS+O2═Hg+SO2
请用双线桥法标出该反应中电子转移的方向和数目 并指出氧化剂或还原剂.(1)Br2+2KI=2KBr+
请用双线桥法标出该反应中电子转移的方向和数目,并指出氧化剂或还原剂.(1)Br2+2KI=2KBr+I2 氧化剂是______(2)3Cl2+6NaOH(热,浓)═5NaC












