将4.368 g铁粉完全溶于150 mL 2.0 mol·L-1的稀HCl中 然后通入0.009 m
| 将4.368 g铁粉完全溶于150 mL 2.0 mol·L-1的稀HCl中,然后通入0.009 mol Cl2,再加入2.94 g重铬酸钾晶体(K2Cr2O7)恰好使溶液中的Fe2+全部转化为Fe3+,重铬酸钾被还原为铬的低价阳离子,已知K2Cr2O7的相对分子质量为294,试求产物中铬元素的化合价。 |
参考解答
| 铬的化合价为+3 |
设产物中铬的化合价为x,根据得失电子守恒有: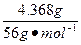 ×1='0.009' mol×2+ ×1='0.009' mol×2+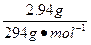 (6-x)×2,x=+3。 (6-x)×2,x=+3。 |
相似问题
下列微粒中 只有氧化性的是( )A.FeB.Fe2+C.Fe3O4D.Fe3+
下列微粒中,只有氧化性的是( )A.FeB.Fe2+C.Fe3O4D.Fe3+
一定条件下 与I-发生反应的离子方程式为:+6I-+6H+====R-+3I2+3H2O 试根据化合
一定条件下,与I-发生反应的离子方程式为:+6I-+6H+====R-+3I2+3H2O,试根据化合价规则和氧化还原反应中得失电子总数相等的原则,推断中n的数值为_______
配平下列氧化还原反应方程式 标出电子转移方向和数目 并完成下列问题:(1)Cl2+KOH——KCl+
配平下列氧化还原反应方程式,标出电子转移方向和数目,并完成下列问题:(1)Cl2+KOH——KCl+KClO3+H2O氧化剂是__________,还原剂是__________,两者的
在2FeBr2+3Cl2===2FeCl3+2Br2的反应中 被氧化的元素是[ ]A.Fe
在2FeBr2+3Cl2===2FeCl3+2Br2的反应中,被氧化的元素是[ ]A.Fe B.Br C.Fe和Br D.Cl
磁性氧化铁与稀HNO3发生反应:3Fe3O4+28HNO3=9Fe(NO3)x+NO↑+14H2O。
磁性氧化铁与稀HNO3发生反应:3Fe3O4+28HNO3=9Fe(NO3)x+NO↑+14H2O。下列判断合理的是 [ ]A.Fe(NO3)x中的x为2 B.反应中每生成0 2mol还原产物,就有0












