某实验小组把CO2通入饱和Na2CO3溶液制取NaHCO3 装置如图所示(气密性已检验 部分夹持装置
某实验小组把CO2通入饱和Na2CO3溶液制取NaHCO3,装置如图所示(气密性已检验,部分夹持装置略):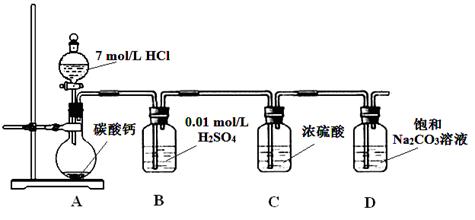 (1)D中产生NaHCO3的化学方程式是 。 (2)请结合化学平衡移动原理解释B中溶液的作用 。 (3)当D中有大量白色固体析出时,停止实验,将固体过滤、洗涤、干燥备用。为确定固体的成分,实验小组设计方案如下(称取一定质量的固体,配成1000 mL溶液作为样液,其余固体备用): ① 方案1:取样液与澄清的Ca(OH)2溶液混合,出现白色沉淀。 实验小组对现象产生的原理进行分析,认为该方案不合理,理由是 。 ② 方案2:取样液与BaCl2溶液混合,出现白色沉淀并有气体产生。 实验小组认为固体中存在NaHCO3,其离子方程式是 。 该小组认为不能确定是否存在Na2CO3,你认为该结论是否合理?_____。 ③ 方案3:实验小组中甲、乙同学利用NaHCO3的不稳定性进行如下实验: 甲同学:取样液400 mL,用pH计测溶液pH,再水浴加热蒸发至200 mL,接下来的操作是 ,结果表明白色固体中存在NaHCO3。为进一步证明白色固体是否为纯净的NaHCO3,结合甲同学实验,还应补充的实验是 。 乙同学:利用仪器测定了固体残留率随温度变化的曲线,如下图所示。 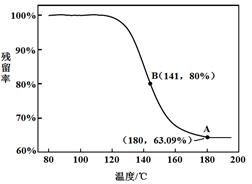 a. 根据A点坐标得到的结论是 。 b. 根据B点坐标,计算残留固体中n(NaHCO3:n(Na2CO3))= 。  通过上述实验,该小组认为,可以向饱和Na2CO3溶液中通入过量CO2制备NaHCO3。 |
参考解答
| (1)Na2CO3+CO2+H2O = 2NaHCO3 (2分) (2)CO2在水中存在平衡:CO2+H2O  H2CO3 H2CO3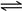 HCO3-+H+,有H2SO4存在时,可使上述平衡向左移动,从而减少CO2在水中的溶解,同时吸收挥发出来的HCl气体(2分) HCO3-+H+,有H2SO4存在时,可使上述平衡向左移动,从而减少CO2在水中的溶解,同时吸收挥发出来的HCl气体(2分)(3)① Na2CO3和NaHCO3都能跟Ca(OH)2溶液发生反应生成白色沉淀,无法确定固体的成分中是否含有NaHCO3。(2分) ② 2HCO3-+Ba2+=BaCO3↓+ CO2↑+H2O(2分) 合理(1分) ③ 接下来的操作:冷却到室温,加水至溶液体积为400 mL,再次测定pH(2分) 补充实验:取相同质量的纯净的NaHCO3配成1000 mL溶液,取400 mL,重复甲的实验,进行对照。(2分) a.白色固体为NaHCO3(2分) b.71:42(或1.69)(1分) |
试题分析: A装置中反应制备CO2,其中有杂质HCl、H2O(g),B装置既减少CO2的溶解,又能吸收HCl,C装置干燥CO2,D装置制备碳酸氢钠。(3)Na2CO3和NaHCO3都能和Ca(OH)2反应生成白色沉淀,方案1不合理,方案2 Na2CO3和BaCl2反应有白色沉淀,NaHCO3和BaCl2反应有白色沉淀和气体,因此可以确定NaHCO3存在,但不能确定Na2CO3的存在。方案3 Na2CO3和NaHCO3溶液都显碱性,但水解程度不同,可通过比较PH值前后大小进行区别。乙同学在温度为180时,残留率正好符合NaHCO3完全分解的计算,B点根据差量法进行计算,设原来有100克NaHCO3,反应后剩余80克,减少20克是CO2和H2O的质量,列方程组计算。 |
相似问题
将金属钾投入到氯化铁溶液中 产物是( )A.OH H2B.Fe(OH)3 KCl H2C.e KCl
将金属钾投入到氯化铁溶液中,产物是()A.OH,H2B.Fe(OH)3,KCl,H2C.e,KClD.HCl,Fe(OH)3,KCl
a g下列物质在氧气中充分燃烧后的气体(1.01×105 Pa 120℃) 通过足量的过氧化钠充分反
a g下列物质在氧气中充分燃烧后的气体(1 01×105 Pa,120℃),通过足量的过氧化钠充分反应后,过氧化钠增重b g,符合b>a 的选项有A.HCHOB.CH3COOCH2CH3C.HOOCCOOHD.蔗糖
将一小块钠投入到NH4Cl溶液中 产生的气体是( )A.O2和H2B.只有H2C.只有NH3D.
将一小块钠投入到NH4Cl溶液中,产生的气体是()A.O2和H2B.只有H2C.只有NH3D.H2和NH3
下列说法正确的是A.氢氧化钠溶液应保存在带磨砂玻璃塞的无色细口瓶中B.硅是制造光导纤维的材料C.水玻
下列说法正确的是A.氢氧化钠溶液应保存在带磨砂玻璃塞的无色细口瓶中B.硅是制造光导纤维的材料C.水玻璃可用作木材防火剂D.水晶是一种无色,坚硬难熔
为测定Na2CO3和NaHCO3固体混合物中Na2CO3的质量分数 称取一定质量的样品 甲同学利用图
为测定Na2CO3和NaHCO3固体混合物中Na2CO3的质量分数,称取一定质量的样品,甲同学利用图I所示装置测量产生CO2的体积,乙同学利用图II所示装置通过干燥管












