某实验小组对中学课本中可生成氢气的反应进行了研究 总结出四个可以生成H2的反应:①Zn+盐酸②Na+
某实验小组对中学课本中可生成氢气的反应进行了研究,总结出四个可以生成H2的反应:①Zn+盐酸②Na+水 ③Al+NaOH溶液④Na+无水乙醇。为点燃上述四个反应生成的H2,他们设计了如下装置图: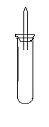 请回答下列问题: ⑴写出Na与H2O反应的化学方程式 ; ⑵在点燃H2之前必须先进行 ,方法是 ; ⑶实验小组在点燃用上述装置制得的H2时,①③④实验获得成功,②却 失败了。他们分析认为失败的原因是Na与H2O的反应速率太快,Na的 用量太少。于是他们准备增加钠的用量,可老师说太危险,你认为产生危 险的原因是 。 ⑷实验小组查阅钠、苯、水的密度分别为0.97g/mL、0.88g/mL、1.00g/mL,并据此对实验进行了改进。 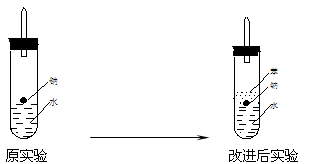 在改进后的实验中H2的生成速率减慢。原因是 。 |
参考解答
| ⑴2Na+2H2O=2NaOH+H2↑ ⑵验纯,用向下排气法收集一试管氢气,用拇指堵住,移近火焰,移开拇指点火。若听到轻微的“扑”声,则表明H2纯净。 ⑶较多的钠与水反应放出大量的热,使试管内H2与O2的混和气点燃而爆炸。 ⑷钠比水轻,比苯重,落在苯水交界处。钠与H2O反应产生的H2使钠浮起,脱离水面,反应停止;当钠表面的H2逸出,钠又回落,与水反应,如此反复,就可减慢Na与H2O反应速度。 |
| ⑴钠是活泼的金属,与H2O反应的化学方程式为2Na+2H2O=2NaOH+H2↑。 (2)氢气是可燃性气体,在点燃H2之前必须先进行验纯,一般采用爆鸣法,即用向下排气法收集一试管氢气,用拇指堵住,移近火焰,移开拇指点火。若听到轻微的“扑”声,则表明H2纯净。 (3)由于钠是活泼的金属,较多的钠与水反应放出大量的热,使试管内H2与O2的混和气点燃而爆炸。 (4)钠比水轻,但比苯重,这样钠将落在苯和水的交界处。钠与H2O反应产生的H2使钠浮起,脱离水面,反应停止;当钠表面的H2逸出,钠又回落,与水反应,如此反复,就可减慢Na与H2O反应速度。 |
相似问题
将一小块金属钠久置于空气中 有下列现象:①生成白色粉末;②变暗;③生成白色固体;④发生潮解变为液体
将一小块金属钠久置于空气中,有下列现象:①生成白色粉末;②变暗;③生成白色固体;④发生潮解变为液体,这些现象的先后顺序是()A.①②③④B.④③
(6分)将一定量NaHCO3和Na2CO3的混合物充分加热 使NaHCO3完全分解 混合物质量减少了
(6分)将一定量NaHCO3和Na2CO3的混合物充分加热,使NaHCO3完全分解,混合物质量减少了3 1g,将加热后剩余的固体物质与足量盐酸反应,收集到8 8g气体。计
下列有关Na2CO3和NaHCO3性质的比较中 错误的是A.可以用加热的方法除去Na2CO3固体中的
下列有关Na2CO3和NaHCO3性质的比较中,错误的是A.可以用加热的方法除去Na2CO3固体中的NaHCO3B.要除去小苏打溶液中少量的苏打杂质,可通入足量的CO2C.
除去NaCl溶液中的Ca2+ Mg2+ SO42— HCO3—等离子 通常采用以下几种试剂:①Na2
除去NaCl溶液中的Ca2+、Mg2+、SO42—、HCO3—等离子,通常采用以下几种试剂:①Na2CO3②BaCl2③NaOH④盐酸,加入试剂的合理操作顺序是A.①②③④B.③②
在10mL 0.01mol·L-1的纯碱溶液中 逐滴加入1.2mL 0.05mol·L-1的盐酸并不
在10mL 0 01mol·L-1的纯碱溶液中,逐滴加入1 2mL 0 05mol·L-1的盐酸并不断搅拌,完全反应后在标准状况下生成二氧化碳的体积是()A.1 344mLB.2 240mLC.0 672mLD.0mL












