(16分). 化学兴趣小组设定以下实验方案 测定某已部分变质为Na2CO3的小苏打样品中NaHCO3
| (16分). 化学兴趣小组设定以下实验方案,测定某已部分变质为Na2CO3的小苏打样品中NaHCO3的质量分数。 方案一:称取一定质量样品,置于坩埚中加热至恒重,冷却,称量剩余固体质量,计算。 (1)坩埚中发生反应的化学方程式为: (2)实验中需加热至恒重的目的是: 方案二:称取一定质量样品,置于小烧杯中,加适量水溶解;向小烧杯中加入足量Ba(OH)2溶液,过滤,洗涤,干燥沉淀,称量固体质量,计算。 (1)过滤操作中,除了烧杯、漏斗外,还要用到的玻璃仪器为 (2)实验中判断沉淀是否完全的方法是 方案三:按如图装置进行实验: 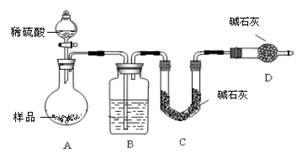 (1)B装置内所盛试剂是 ;D装置的作用是 ;分液漏斗中 (填“能”或“不能”)用盐酸代替稀硫酸进行实验。 (2)实验前称取17.9g样品,实验后测得C装置增重8.8g,则样品中NaHCO3的质量分数为 。 (3)根据此实验测得的数据,测定结果有误差,因为实验装置还存在一个明显缺陷是 : |
参考解答
方案一:(1)2NaHCO3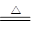 Na2CO3+H2O+CO2↑(2分) Na2CO3+H2O+CO2↑(2分)(2)保证NaHCO3分解完全(2分) 方案二:(1)玻璃棒(2分); (2)取少量上层清液于试管中,滴加一滴Ba(OH)2溶液,观察是否有白色沉淀生成(2分) 方案三:(1)浓硫酸(1分)防止空气中的水蒸气、CO2进入C装置(2分) 不能(1分) (2)70.4%(70%) (3)缺少一套将A、B装置内的CO2气体驱赶到C装置中的装置(或其他合理答案)(2分) |
方案一:(1)碳酸氢钠不稳定,受热易分解,方程式是2NaHCO3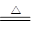 Na2CO3+H2O+CO2↑。 Na2CO3+H2O+CO2↑。(2)为保证NaHCO3分解完全,必须加热至恒重。 方案二:(1)过滤时还需要玻璃棒引流。 (2)判断沉淀是否完全的方法是继续加入氢氧化钡,即取少量上层清液于试管中,滴加一滴 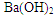 溶液,观察是否有白色沉淀生成。 溶液,观察是否有白色沉淀生成。方案三:(1)根据装置图可知,原理是利用盐和稀硫酸反应生成CO2,然后通过碱石灰吸收CO2,进而得出CO2的质量。由于生成的CO2中含有水蒸气,所以B中的试剂应该是浓硫酸,目的除去水蒸气;由于空气中也含有水蒸气和CO2,所以D装置的作用是防止空气中的水蒸气、CO2进入C装置;由于盐酸易挥发,所以生成CO2中一定含有氯化氢,而氯化氢能和碱石灰反应,所以不能用盐酸代替。 (2)设样品中碳酸钠和碳酸氢钠的物质的量分别是x和y,则106x+84y=17.9g。生成的CO2是8.8g,物质的量是0.2mol,所以x+y=0.2mol,解得y=0.15mol,所以碳酸氢钠的质量分数是 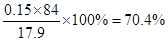 。 。(3)由于装置中一定含有残留的没有被吸收的CO2,所以还缺少一套将A、B装置内的CO2气体驱赶到C装置中的装置。 |
相似问题
下列物质中可用于治疗胃酸过多的是( )A.碳酸钠B.氢氧化铝C.氧化钙D.碳酸钡
下列物质中可用于治疗胃酸过多的是( )A.碳酸钠B.氢氧化铝C.氧化钙D.碳酸钡
根据下列转化关系以及现象回答:(1)固体X的名称是 Y的化学式是 。
根据下列转化关系以及现象回答:(1)固体X的名称是,Y的化学式是。(2)写出反应l的化学方程式。(3)写出反应2的化学方程式。(4)若15.6g X和足量水
2.1g平均相对分子质量为7.2的CO和H2组成的混合气体在足量O2中充分燃烧后 将产生的气体立即通
2 1g平均相对分子质量为7 2的CO和H2组成的混合气体在足量O2中充分燃烧后,将产生的气体立即通入到足量Na2O2固体中,固体增加的质量是A.2 1 g B.3
(10分)有四种钠的化合物W X Y Z 在一定条件下能发生如下反应(反应条件略):① W X +
(10分)有四种钠的化合物W、X、Y、Z,在一定条件下能发生如下反应(反应条件略):① W X + CO2 + H2O;② Z + CO2X + O2;③ Z + H2OY
关于Na2CO3和NaHCO3性质的说法 正确的是 A.热稳定性:NaHCO3 > Na2CO3B.
关于Na2CO3和NaHCO3性质的说法,正确的是 A.热稳定性:NaHCO3 > Na2CO3B.与澄清石灰水反应:Na2CO3、NaHCO3溶液中均有沉淀生成C.相同温度时,在水












