(9分)某次化学兴趣小组活动上 三组学生分别用图示甲 乙两装置 探究“NaHCO3和Na2CO3与稀
(9分)某次化学兴趣小组活动上,三组学生分别用图示甲、乙两装置,探究“NaHCO3和Na2CO3与稀盐酸的反应”,按表中的试剂用量,在相同条件下,将两个气球中的固体粉末同时倒入试管中(装置的气密性已检查)请回答: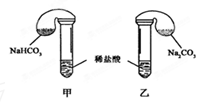 (1)(3分)各组反应开始时,______装置中的气球体积先变大,该装置中反应的离子方程式是 。 (2)(6分)当试管中不再有气体生成时,三组实验出现不同现象。请参照第①组,分析原因的方式填写下表的空格 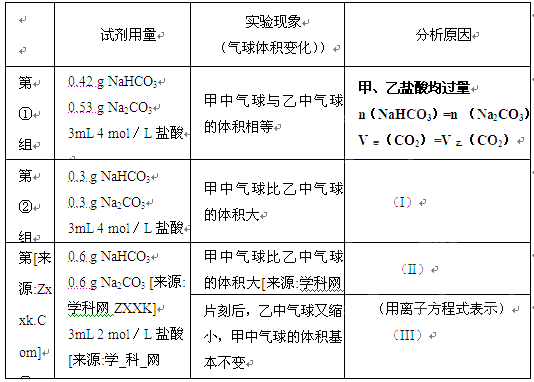 |
参考解答
| (9分) (1)(3分)_____甲____、___HCO3-+H+==H2O+ CO2↑________ (2)(6分)当试管中不再有气体生成时,三组实验出现不同现象。请参照第①组,分析原因的方式填写下表的空格 甲、乙盐酸均过量 n(NaHCO3)='n' (Na2CO3 V甲(CO2)=V乙(CO2) (I)甲、乙盐酸均过量 n(NaHCO3)>n(Na2CO3) V(CO2)甲>V(CO2)乙 (II)甲、乙盐酸均不足量, 消耗的n(NaHCO3)>n (Na2CO3) V(CO2)甲>V(CO2)乙 (III)CO2+H2O+CO32-='2' HCO3- |
方法:(1)根据生成二氧化碳的反应速率判断; (2)清楚发生反应,根据过量计算判断CO2气体产生的量,分析现象的原因. (I)先判断酸是否过量,再计算碳酸钠、碳酸氢钠的物质的量的关系,从而确定生成气体的关系; (II)先判断酸是否过量,再计算碳酸钠、碳酸氢钠的物质的量的关系,从而确定生成气体的关系; (III)根据溶液的成分及二氧化碳的性质分析. 解:(1)甲装置发生反应:HCO3-+H+═H2O+CO2↑;乙装置发生反应:CO32-+H+═HCO3-,HCO3-+H+═H2O+CO2↑,甲装置内反应速率较快,单位时间产生的CO2多,故甲装置中的气球体积先变大. 故答案为:甲;HCO3-+H+═H2O+CO2↑; (2)(I)质量相同的碳酸氢钠和碳酸钠,碳酸氢钠的物质的量大于碳酸钠的物质的量,一个碳酸钠和碳酸氢钠分子中含有的碳原子个数相同,所以与过量的盐酸反应后,碳酸氢钠生成的二氧化碳多. 故答案为:甲、乙盐酸均过量,n(NaHCO3)>n(Na2CO3),V(CO2)甲>V(CO2)乙; (II)盐酸的物质的量=6×10-3mol,n(NaHCO3)=0.6g/84g·mol-1=7.1×10-3mol, n(Na2CO3)=0.6g/106g·mol-1=5.7×10-3mol,通过(1)方程式知,盐酸均不足量,与相同物质的量的盐酸反应,消耗的n(NaHCO3)>n (Na2CO3),生成的 V(CO2)甲>V(CO2)乙. 故答案为:甲、乙盐酸均不足量,消耗的n(NaHCO3)>n (Na2CO3) V(CO2)甲>V(CO2)乙; (III)该反应有剩余的碳酸钠,生成的二氧化碳又和碳酸钠反应生成碳酸氢钠,所以气体体积减少,乙中气球会缩小,反应的离子方程式为CO2+H2O+CO32-='2' HCO3-. 故答案为:CO2+H2O+CO32-='2' HCO3-. |
相似问题
下列物质混合后不能生成氢氧化钠的是A.Ba(OH)2和Na2CO3溶液 B.Na和H2OC.KOH
下列物质混合后不能生成氢氧化钠的是A.Ba(OH)2和Na2CO3溶液 B.Na和H2OC.KOH和NaCl溶液D.Na2O2和H2O
下列关于碳酸钠和碳酸氢钠的比较中 正确的是( )A.热稳定性:Na2CO3 < NaHCO3B.碱性
下列关于碳酸钠和碳酸氢钠的比较中,正确的是()A.热稳定性:Na2CO3 < NaHCO3B.碱性:Na2CO3 < NaHCO3C.水中的溶解度:Na2CO3 > NaHCO3D.与足
在120℃的条件下 总质量为2.1 g的CO与H2的混合气体在足量的O2中充分燃烧 然后通过足量的N
在120℃的条件下,总质量为2 1 g的CO与H2的混合气体在足量的O2中充分燃烧,然后通过足量的Na2O2固体,固体增加的质量为()A.7 2 gB.4 2 gC.2 1 gD.3 6 g
下列说法正确的是:A.金属钠加入硫酸铜溶液中可置换出铜B.单质钠在空气中加热生成白固体氧化钠C.因煤
下列说法正确的是:A.金属钠加入硫酸铜溶液中可置换出铜B.单质钠在空气中加热生成白固体氧化钠C.因煤油的密度比钠小,钠不与煤油反应,所以钠可保存在
在一密封容器中盛有0.8mol Na2O2与1mol NaHCO3 将其加热到3000C 经充分反应
在一密封容器中盛有0 8mol Na2O2与1mol NaHCO3,将其加热到3000C,经充分反应后,容器内残留的固体是A.0 5mol Na2CO3和1mol NaOHB.1mol Na2CO3和0












