X Y Z W是周期表中原子序数依次增大的前20号元素.X Y同周期 Y Z同主族.Zn-与Wn+离
X、Y、Z、W是周期表中原子序数依次增大的前20号元素.X、Y同周期,Y、Z同主族.Zn-与Wn+离子的电子层结构相同.由这四种元素形成的单质、化合物有如图转化关系.已知:常温下A为液体,B、C、E、G为气态化合物,且A、C、G均为直线型分子;D是由元素W、Y形成的常见化合物.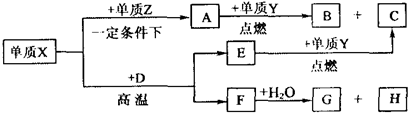 (1)元素W的名称______,Z的原子结构示意图______,A的电子式______. (2)写出D、E的化学式:D:______、E:______. (3)①已知38gA与Y完全反应生成B、C时放出akJ的热量,写出该反应的热化学方程式:______. ②F与水反应的化学方程式:______. |
参考解答
| 根据转化关系,单质Y在点燃情况下才能与A、E反应,可猜想单质Y为O2;Y、Z同主族,则Z为S;Zn-与Wn+离子的电子层结构相同,推知W为Ca,D为CaO,与钙元素相关的,反应生成的直线型分子应该为C2H2,推知F为CaC2,H为Ca(OH)2,X为C,C在高温下与CaO反应生成CaC2和CO,推知E为CO,C为CO2,单质C和单质S在一定条件下形成直线型的CS2分子,CS2在O2中燃烧生成SO2和CO2.将所得结论代入题设框图验证可知完全正确. (1)由上述分析可知,W为钙元素;Z为硫元素,质子数为16,核外电子数为16,有3个电子层,最外层有6个电子,原子结构化示意图为 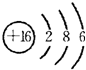 ;CS2的电子式与二氧化碳电子式类似,所以CS2的电子式为 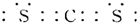 , 故答案为:钙;  ; 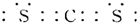 ; (2)由上述分析可知,D为CaO,E为CO,故答案为:CaO;CO; (3)①38gCS2(l)为0.5mol,与O2(g)完全反应生成CO2(g)和SO2(g),放出a kJ热量,则1 mol CS2(l)与O2(g)完全反应生成CO2(g)和SO2(g)放出2a kJ热量,所以热化学方程式为CS2(l)+3O2(g)═CO2(g)+2SO2(g)△H=-2akJ/mol, 故答案为:CS2(l)+3O2(g)═CO2(g)+2SO2(g)△H=-2akJ/mol; ②碳化钙与水反应生成氢氧化钙与乙炔,反应方程式为CaC2+2H2O→C2H2↑+Ca(OH)2,故答案为:CaC2+2H2O→C2H2↑+Ca(OH)2. |
相似问题
现有一包固体可能由下列一种或几种物质组成:CuSO4 NaI KNO3 NH4Cl BaCl2 Na
现有一包固体可能由下列一种或几种物质组成:CuSO4、NaI、KNO3、NH4Cl、BaCl2、Na2CO3,为了鉴别做以下实验:(1)将一定量的固体溶于水,得到无色澄清的
下面图表示制备无水盐E的主要步骤:已知B是石灰石 D盐含有约49%的结晶水 无水盐E可用作干燥剂.取
下面图表示制备无水盐E的主要步骤:已知B是石灰石,D盐含有约49%的结晶水,无水盐E可用作干燥剂.取少量E溶于水,向其中滴加硝酸后,再滴加硝酸银溶液,
下列转化关系图中 A B C D E常温下为气体 B E F K为单质 其中F为黑色固体;C D均
下列转化关系图中,A、B、C、D、E常温下为气体,B、E、 F、K为单质,其中F为黑色固体;C、D均能使澄清的石灰水变混浊,D、E均能使品红溶液褪色;I是一种
如下图转化关系中 常温下E F L I为无色气体 F是形成酸雨的主要原因之一 D为无色液体 M是淡黄
如下图转化关系中,常温下E、F、L、I为无色气体,F是形成酸雨的主要原因之一,D为无色液体,M是淡黄色固体,在E的水溶液中通入过量的F得到A。 试回答下
如图 B为常见金属或非金属单质 有下列转化关系:若C是可用作自来水消毒的气体 D E是氧化物 D转化
如图,B为常见金属或非金属单质,有下列转化关系:若C是可用作自来水消毒的气体,D、E是氧化物,D转化为E时,增加氧的质量约是D物质总质量的25 8%,则A是












