(10分)(1)用氨 空气 水为原料制取硝酸铵 如果制取160 t硝酸铵至少需要多少吨氨?(2)若用
| (10分)(1)用氨、空气、水为原料制取硝酸铵,如果制取160 t硝酸铵至少需要多少吨氨? (2)若用NH3制取NO转化率为96%,NO转化为硝酸的利用率为92%,问用于制取HNO3的氨占全部氨的物质的量分数是多少? |
参考解答
| (1)68 t (2)53% |
工业上用氨制NH4NO3的过程是:将氨分成两部分,一部分用于合成HNO3,另一部分用于与生成的硝酸反应合成NH4NO3。如下图: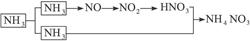 (1)NH4NO3中氮元素均来源于NH3,根据守恒原理可知,与HNO3反应的氨气量与用于合成硝酸的氨气量相等,所以有如下关系式: NH4NO3 — 2NH3 (即1 mol NH4NO3至少需2 mol NH3) 80 34 160 x 80∶160=34∶x x='68' t (2)由上面的分析可以看出,若每一步都100%转化,两部分氨应各占一半。但由于制HNO3的NH3未完全转化,总的转化率相当于96%×92%,所以NH3的用量肯定大于50%。设用于制HNO3的氨为1 mol  即:共用NH31.88 mol 用于制HNO3的NH3应占: 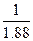 ×100%=53% ×100%=53% |
相似问题
用MnO2和浓盐酸制取氯气。当4mol氯化氢被氧化 生成的氯气的体积(标况)是( )A.22.4L
用MnO2和浓盐酸制取氯气。当4mol氯化氢被氧化,生成的氯气的体积(标况)是( )A.22 4LB.44 8LC.67 2LD.89 6L
某地有一池塘 生长着丰富的水生植物和多种鱼虾。后来 由于化工厂将大量污水排入池塘中 使水质恶化 各种
某地有一池塘,生长着丰富的水生植物和多种鱼虾。后来,由于化工厂将大量污水排入池塘中,使水质恶化,各种水生生物先后死亡。根据题意回答下列问题:(1
已知次碘酸(HIO)既能和酸发生中和反应又能和碱发生中和反应 它与盐酸反应将生成( )A.IO
已知次碘酸(HIO)既能和酸发生中和反应又能和碱发生中和反应,它与盐酸反应将生成()A.IOClB.IClC.HID.HClO
下列不能用来区别二氧化硫和二氧化碳两种气体的试剂是A 澄清的石灰水 B 酸性高锰酸钾溶液 C 溴水
下列不能用来区别二氧化硫和二氧化碳两种气体的试剂是A 澄清的石灰水 B 酸性高锰酸钾溶液 C 溴水 D 品红溶液
正好能还原1 mol H+的是( )A.17 g OH-B.23 g NaC.71 g Cl2
正好能还原1 mol H+的是( )A.17 g OH-B.23 g NaC.71 g Cl2D.9 g Al












