二氧化硫是硫的重要化合物 在生产 生活中有广泛应用。二氧化硫有毒 并且是形成酸雨的主要气体。无论是实
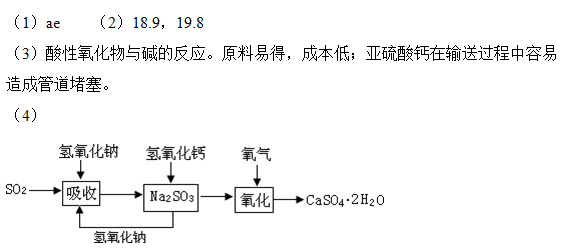
| 二氧化硫是硫的重要化合物,在生产、生活中有广泛应用。二氧化硫有毒,并且是形成酸雨的主要气体。无论是实验室制备还是工业生产,二氧化硫尾气吸收或烟气脱硫都非常重要。完成下列填空: (1)实验室可用铜和浓硫酸加热或硫酸和亚硫酸钠反应制取二氧化硫。 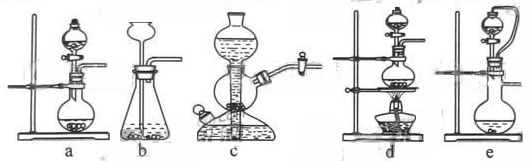 如果用硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,上图中可选用的发生装置是 (填写字母)。 (2)若用硫酸和亚硫酸钠反应制取3.36L(标准状况)二氧化硫,至少需要称取亚硫酸钠 g(保留一位小数);如果已有4.0%亚硫酸钠(质量分数),被氧化成硫酸钠,则至少需称取该亚硫酸钠 g(保留一位小数)。 (3)实验室二氧化硫尾气吸收与工业烟气脱硫的化学原理相通。 石灰—石膏法和碱法是常用的烟气脱硫法。石灰-石膏法的吸收反应为:SO2+Ca(OH)2=CaSO3↓+H2O。吸收产物亚硫酸钙由管道输送至氧化塔氧化,反应为2CaSO3+O2+4H2O=2CaSO4·2H2O。其流程如下图: 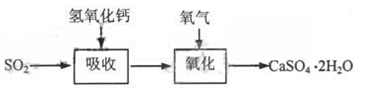  碱法的吸收反应为SO2+2NaOH=Na2SO3+H2O。碱法的特点是氢氧化钠碱性强、吸收快、效率高。其流程如下图: 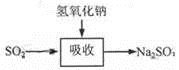 已知:
石灰-石膏法和碱法吸收二氧化硫的化学原理相同之处是 。和碱法相比,石灰-石膏法的优点是 ,缺点是 。 (4)在石灰-石膏法和碱法的基础上,设计一个改进的、能实现物料循环的烟气脱硫方案(用流程图表示)。 |
参考解答
 |
| (1)用硫酸和亚硫酸钠制取SO2的试剂为固态和液态,反应条件不需加热,可通过控制添加硫酸的速率来控制反应速率,结合装置可知a、e可达到目的; (2) H2SO4+Na2SO3=Na2SO4+SO2+H2O 126g 22.4L m 3.36L m=18.9g 4g亚硫酸钠被氧化为硫酸钠后的质量变为4.5g,则有4.0%亚硫酸钠被氧化为硫酸钠的样品中,亚硫酸钠的质量分数为95.5%,因此称取样品的质量为19.8g。 (3)石灰-石膏法与碱法吸收SO2都是利用SO2是酸性氧化物可与碱反应的性质来吸收SO2的;利用题中已知和有关信息可知采用石灰-石膏法所用原料易得、成本低等,但因Ca(OH)2碱性弱,导致吸收速率慢、效率低; (4)依据上述流程操作存在的缺点,能实现物料循环的烟气脱硫方案 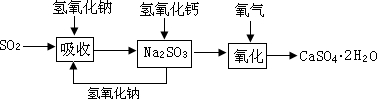 |
相似问题
已知某物质X能发生如下转化:下列有关上述转化关系中物质及其反应的叙述错误的是A若X??N2或NH3(
已知某物质X能发生如下转化:下列有关上述转化关系中物质及其反应的叙述错误的是A若X??N2或NH3(催化氧化),则A为硝酸B若X为S 或H2S(完全燃烧),则A
含有amol FeBr2的溶液中 通入xmol Cl2。下列各项为通Cl2过程中 溶液内发生反应的离
含有amol FeBr2的溶液中,通入xmol Cl2。下列各项为通Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是 [ ]A.x=0.4a,2Fe2+ +Cl2 =2Fe3
取三张蓝色石蕊试纸置于表面皿上 然后按顺序滴加65%的硝酸 98.3%的硫酸和新制氯水 三张试纸最终
取三张蓝色石蕊试纸置于表面皿上,然后按顺序滴加65%的硝酸,98.3%的硫酸和新制氯水,三张试纸最终呈现的颜色是 [ ]A.白 红 白 B.红 黑 红 C
为了防治酸雨 减少煤燃烧时向大气排放的SO2 工业上采用生石灰和含硫的煤混合使用以“固硫”(避免硫的
为了防治酸雨,减少煤燃烧时向大气排放的SO2,工业上采用生石灰和含硫的煤混合使用以“固硫”(避免硫的化合物进入大气),最后生成石膏。试回答:(1)整个
下列各组物质不能按“→”所示关系实现转化的是(“→”表示反应一步完成) [ ]A.B.C.D
下列各组物质不能按“→”所示关系实现转化的是(“→”表示反应一步完成) [ ]A.B.C.D.












