如图 某学习小组利用下列装置探究氯气氨气之间的反应 其中A F分别为氯气和氨气的发生装置 D为纯净的
如图,某学习小组利用下列装置探究氯气氨气之间的反应,其中A、F分别为氯气和氨气的发生装置,D为纯净的氯气和氨气的反应装置.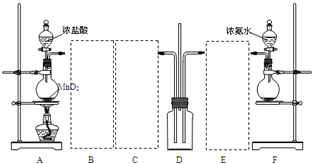 请回答下列问题: (1)装置F中烧瓶内的固体可选用______ A、氯化铝 B、生石灰 C、五氧化二磷 D、烧碱 (2)实验中所用的浓盐酸的质量分数为36.5%,其密度为1.19 g/cm3,则其物质的量浓度为______(保留两位小数),在标况下需______L(保留两位小数)氯化氢溶于1L水中才可得此浓度的盐酸. (3)虚线框内应添加必要的除杂装置,请将除杂装置中相应的试剂名称填入下列空格中:B______;C______;E______. (4)装置D内出现白烟并在容器内壁凝结,鉴定该固体是氯化铵所需要的试剂有:______. (5)有同学认为D中除了有氯化铵生成外,还应有其他物质生成,你认为他的理由是______.如果D中气体未出现红棕色,也没有白烟产生,则D中发生反应的化学方程式是______. |
参考解答
| (1)A、C都能够和氨水反应,无法制取氨气;B、D都可以使浓氨水迅速产生氨气,故答案的:BD; (2)1L溶液的质量为:1.19×1000×1=1190(g),c(HCl)=
(3)氯气在饱和食盐水中溶解度较小,故用饱和食盐水出去氯气中混有的氯化氢,所以B为饱和食盐水;浓硫酸不与氯气反应,干燥效果好,故制取氯气常用浓硫酸作干燥剂,故C为浓硫酸;E是干燥氨气的试剂,通常使用碱石灰,故E为碱石灰, 故答案为:饱和食盐水;浓硫酸;碱石灰; (4)鉴定该固体是氯化铵,需要分别鉴定铵离子和氯离子,铵离子检验方法是:先加入溶液,产生使红色石蕊试纸变蓝的气体,证明铵离子存在;氯离子检验方法是:先滴加硝酸银溶液,产生沉淀,再加入稀硝酸,沉淀不溶解,证明氯离子存在,故答案是:NaOH溶液和湿润的红色石蕊试纸;硝酸银溶液和稀硝酸; (5)若有氯化铵生成,根据电子守恒,氯气中的氯元素得到电子,化合价降低,一定还有失去电子,化合价升高的元素;由于D中气体未出现红棕色,也没有白烟产生,可以断定氨气中的氮元素应后生成了氮气,发生的反应为2NH3+3Cl2═N2+6HCl, 故答案为:化合价如果只生成氯化铵,化合价只有降而没有升,不符合氧化还原反应得失电子相等的规律;2NH3+3Cl2═N2+6HCl. |
相似问题
某科研小组用MnO2和浓盐酸制备Cl2时 利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理。
某科研小组用MnO2和浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理。(1)请写出MnO2和浓盐酸制备Cl2的离子方程式_______________
下列各组物质可做喷泉实验的是( )A.C12和水B.H2和水C.NH3和水D.CO2和水
下列各组物质可做喷泉实验的是( )A.C12和水B.H2和水C.NH3和水D.CO2和水
下列实验设计和结论相符的是 [ ]A. 在含FeCl2杂质的FeCl3溶液中通足量Cl2后
下列实验设计和结论相符的是[ ]A 在含FeCl2杂质的FeCl3溶液中通足量Cl2后,充分加热,除去过量的Cl2,即可得到较纯净的FeCl3溶液 B 现在媒体谈论的PM
生活中难免会遇到一些突发事件 我们要善于利用学过的知识 采取科学 有效的方法保护自己.如果发生了氯气
生活中难免会遇到一些突发事件,我们要善于利用学过的知识,采取科学、有效的方法保护自己.如果发生了氯气(能与碱性溶液反应)泄漏,以下自救方法得当
下列对实验现象的表述正确的是( )A.将装有等量的NO2与N2O4混合气体的两个容积相同的玻璃球分
下列对实验现象的表述正确的是( )A.将装有等量的NO2与N2O4混合气体的两个容积相同的玻璃球分别浸入热水和冷水中,浸入热水中的玻璃球里气体颜色较












