饱和氯水与石灰石的反应是制取较浓HClO溶液的方法之一。2005年的《化学教育》报道了如下实验研究:
| 饱和氯水与石灰石的反应是制取较浓HClO溶液的方法之一。2005年的《化学教育》报道了如下实验研究: 一、定性研究: 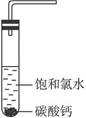 ①在试管中加入过量的块状碳酸钙,再加入约20 mL饱和氯水,充分反应,有少量气泡产生,溶液浅黄绿色褪去;②过滤,将滤液滴在有色布条上,发现其比氯水的漂白性更强;③为了确定反应产物,将滤液分为三份,分别进行以下实验: 第一份与石灰水混合,立即产生大量白色沉淀; 第二份与稀盐酸混合,立即产生大量无色气体; 将第三份加热,看到溶液变浑浊且有大量无色气体产生。 经检测,上述实验中产生的无色气体均为CO2。 请完成下列问题: (1)反应后所得的溶液漂白性增强的原因是____________________________________。 (2)依据上述实验可推知,②的滤液中的溶质除CaCl2、HCIO外,还含有_________。 二、定量研究: 在圆底烧瓶底部,有一用塑料网包住的过量块状碳酸钙和150 mL饱和氯水,按如图所示装置实验,待不再产生气泡后,将塑料网中剩余的石灰石提出液面,密封后再加热、煮沸烧瓶中的液体,直到量筒中的气体不再增加。 请完成下列问题: 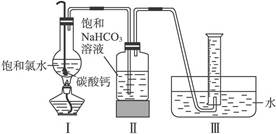 (3)为减少用装置Ⅲ收集气体过程中CO2因溶解而造成的损失,且水槽中仍然为水,请你对装置Ⅲ进行改进,最简单的方法是____________________________________________________。 (4)用改进后的装置进行上述实验,测得塑料网内的碳酸钙质量减少A g,总共收集到标准状况下的CO2气体B L,发现 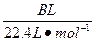 明显小于 明显小于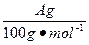 。若不考虑实验操作和CO2的溶解等因素造成的误差,从化学反应原理来看,导致这一大小关系的原因是____________________________________________。 。若不考虑实验操作和CO2的溶解等因素造成的误差,从化学反应原理来看,导致这一大小关系的原因是____________________________________________。(5)实验后发现,装置Ⅱ中的液体增多了,其原因是____________________________________。 |
参考解答
(1)CaCO3消耗了氯水中的HCl,使Cl2+H2O HCl+HClO平衡向右移动,HClO浓度增大 HCl+HClO平衡向右移动,HClO浓度增大(2)Ca(HCO3)2 (3)在导管末端再连接长导管,使导管的出口接近量筒底部 (4)碳酸钙与CO2反应生成的Ca(HCO3)2使生成CO2的物质的量小于 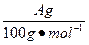 (5)从圆底烧瓶蒸出的水蒸气在广口瓶中冷凝、聚集 |
| 本题是探索性的实验,研究定性和定量的问题和平衡移动的知识及观察能力、误差分析能力。 由于CaCO3消耗了氯水中的HCl,使Cl2+H2O  HCl+HClO平衡向右移动,HClO浓度增大。过量的碳酸钙与释放出的CO2在水中反应生成Ca(HCO3)2。发现 HCl+HClO平衡向右移动,HClO浓度增大。过量的碳酸钙与释放出的CO2在水中反应生成Ca(HCO3)2。发现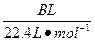 明显小于 明显小于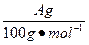 ,原因是CO2并没有完全释放出去。由Ⅰ到Ⅱ会有水蒸发出去,那么在Ⅱ中冷却,所以Ⅱ中的液体增多了。 ,原因是CO2并没有完全释放出去。由Ⅰ到Ⅱ会有水蒸发出去,那么在Ⅱ中冷却,所以Ⅱ中的液体增多了。 |
相似问题
工业上用纯净的消石灰与氯气反应制取漂白粉 已知漂白粉的有效成分为55.17% 求消石灰的利用率.
工业上用纯净的消石灰与氯气反应制取漂白粉,已知漂白粉的有效成分为55 17%,求消石灰的利用率.
新制的氯水 呈浅黄绿色 说明氯水中含有______分子(填化学式);向新制氯水中 加入AgNO3溶液
新制的氯水,呈浅黄绿色,说明氯水中含有______分子(填化学式);向新制氯水中,加入AgNO3溶液有白色沉淀产生,说明氯水中含______离子(填离子符号);
某溶液中含有SO32- SiO32- Br- CO32- Na+ 向该溶液中通入过量的Cl2 下列判
某溶液中含有SO32-、SiO32-、Br-、CO32-、Na+,向该溶液中通入过量的Cl2,下列判断正确的是( )①反应前后,溶液中离子浓度基本保持不变的只有Na+
高氯酸铵在强热条件下分解 生成氮气 氧气 氯化氢和水。反应中生成的还原产物和氧化产物的物质的量之比是
高氯酸铵在强热条件下分解,生成氮气、氧气、氯化氢和水。反应中生成的还原产物和氧化产物的物质的量之比是A.1∶2B.5∶4C.4∶7D.7∶4
工业上常用氯气给自来水消毒.某学生用自来水配制下列物质的溶液 不会产生明显药品变质的是( )A.石
工业上常用氯气给自来水消毒.某学生用自来水配制下列物质的溶液,不会产生明显药品变质的是( )A.石蕊B.硝酸银C.亚硫酸钠D.氯化钠












