日常使用的金属材料 大多数属于合金。黄铜是以锌作主要添加元素的铜合金。(1)赤铜(Cu­2
| 日常使用的金属材料,大多数属于合金。黄铜是以锌作主要添加元素的铜合金。 (1)赤铜(Cu2O)是我国古代制取黄铜的一种原料。Cu2O中铜元素与氧元素的质量比是 。 (2)用来制造弹壳的黄铜只含有锌和铜。将22g弹壳放在盛有100g稀硫酸的烧杯中(硫酸足量),当弹壳不再溶解后,烧杯中混合物的质量是121.8g。计算: ①产生氢气的质量。 ②弹壳中铜的质量。 ③反应后所得溶液中ZnSO4的质量分数(计算结果保留一位小数)。 |
参考解答
| (1)8:1(2)①0.2g②15.5g③15.1% |
试题分析:(1)物质组成元素的质量比:相对原子质量╳原子个数之比。根据赤铜的化学式可知,其中铜元素与氧元素的质量比为:(64×2):(16×1)=128:16=8:1 (2)①根据质量守恒定律可知:反应前后的总质量的差值即为生成的气体—氢气的质量。 ②根据题意可知:题目中的反应为锌与硫酸反应生成氢气。已知量为氢气的质量,未知量为铜的质量。解题思路:可根据化学方程式中氢气与锌的质量关系,先求出参加反应的锌的质量,再进一步求出铜的质量。 ③根据题意可知:已知量为氢气的质量,未知量为所得溶液中硫酸锌的质量分数。解题思路:可根据化学方程式中氢气与硫酸锌的质量关系,先求出反应生成的硫酸锌的质量。然后再根据反应完毕后混合物的质量为硫酸锌溶液的质量和铜的质量之和,可求出所得溶液的质量。进一步求出所得溶液中硫酸锌的质量分数。具体解题过程如下: 解:①根据题意可知,生成氢气的质量为22g+100g-121.8g=0.2g ②设黄铜中锌的质量为x,生成硫酸锌的质量为y; Zn+H2SO4==ZnSO4+H2↑ 65 161 2 x y 0.2g 65:2=x:0.2g x=6.5g 161:2= y:0.2g y=16.1g 弹壳中铜的质量为:22g—6.5g=15.5g ③所得硫酸锌溶液的溶质质量分数为: 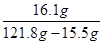 ×100%≈15.1% ×100%≈15.1% |
相似问题
“化学为生命密码解锁” “DNA”承载着生命遗传的密码 胞嘧啶(C4H5ON3)是DNA水解产物之一
“化学为生命密码解锁”,“DNA”承载着生命遗传的密码,胞嘧啶(C4H5ON3)是DNA水解产物之一.(1)胞嘧啶中碳、氢、氧、氮四中元素的质量比为 (2)
原子核外M层有3个电子的原子与L层有6个电子的原子所构成的化合物 其分子量(式量) [ ]
原子核外M层有3个电子的原子与L层有6个电子的原子所构成的化合物,其分子量(式量) [ ]A. 150 B. 102 C. 43 D. 21
(6分)科学家经过多年研究证明 某些零食中含一定量对人体健康有害的物质 如油炸食品中常含有致癌物质丙
(6分)科学家经过多年研究证明,某些零食中含一定量对人体健康有害的物质,如油炸食品中常含有致癌物质丙烯酰胺(C3H5NO)。(1)丙烯酰胺的一个分子是
已知某岩石(钾长石)的化学式为:KAlSi3O8 则该岩石中硅元素的化合价为A.+2B.+3 C.+
已知某岩石(钾长石)的化学式为:KAlSi3O8,则该岩石中硅元素的化合价为A.+2B.+3 C.+4D.+6
测知人尿中含氮量为0.33% 试求人尿中含尿素[CO(NH2)2]的质量分数。请详述解答过程。
测知人尿中含氮量为0 33%,试求人尿中含尿素[CO(NH2)2]的质量分数。请详述解答过程。












