(6分)在一定条件下A与B反应可生成C和D 其能量变化如图:(1)下列有关反应A+B = C+D的说
(6分)在一定条件下A与B反应可生成C和D,其能量变化如图: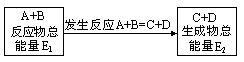 (1)下列有关反应A+B = C+D的说法正确的是 。
|
参考解答
| (1)AD(2)> 吸热 |
试题分析:下列有关反应A+B = C+D的说法正确的是: 反应前后原子的种类和数目一定不变;该反应若有能量变化,则不一定是氧化还原反应,除非化合价有变化;该反应若为放热反应,则不需加热反应不一定能自发进行; 反应物的总质量与生成物的总质量一定相等,且遵循能量守恒。若E1<E2,则生成物的总能量>反应物的总能量,该反应为吸热反应。 点评:化学反应中的能量变化 化学反应中的能量变化,通常表现为热量的变化。探讨化学反应放热、吸热的本质时,要注意四点:①化学反应的特点是有新物质生成,新物质和反应物的总能量是不同的,这是因为各物质所具有的能量是不同的(化学反应的实质就是旧化学键断裂和新化学键的生成,而旧化学键断裂所吸收的能量与新化学键所释放的能量不同导致发生了能量的变化);②反应中能量守恒实质是生成新化学键所释放的能量大于旧化学键断裂的能量而转化成其他能量的形式释放出来;③如果反应物所具有的总能量高于生成的总能量,则在反应中会有一部分能量转变为热能的形式释放,这就是放热反应,反之则是吸热反应;④可用图象来表示。 |
相似问题
下列叙述中正确的是A.只含离子键的化合物才是离子晶体B.(NH4)2SO4晶体是含有离子键 极性共价
下列叙述中正确的是A.只含离子键的化合物才是离子晶体B.(NH4)2SO4晶体是含有离子键、极性共价键和配位键的晶体C.由于I—I中的共价键键能比F—F、Cl—C
现有如下各说法:①仅含共价键的物质就是共价化合物②所有化学反应都要经历旧化学键断裂和新化学键形成③离
现有如下各说法:①仅含共价键的物质就是共价化合物②所有化学反应都要经历旧化学键断裂和新化学键形成③离子键的实质是阴、阳离子间的静电引力④化学反
下列叙述正确的是( )A.预测PCl3的立体构型为平面三角形B.SO2和CO2都是含有极性键
下列叙述正确的是()A.预测PCl3的立体构型为平面三角形B.SO2和CO2都是含有极性键的非极性分子C.在NH和[Cu(NH3)4]2+中都存在配位键D.铝元素的原子核
(6分)(1)在下列变化中 ① I2升华 ②烧碱熔化 ③二氧化硅熔化 ④NaCl溶于水 ⑤HCl溶于
(6分)(1)在下列变化中① I2升华,②烧碱熔化,③二氧化硅熔化,④NaCl溶于水,⑤HCl溶于水,⑥晶体Ar熔化,⑦Na2O2溶于水,⑧NaHSO4溶于水。未破坏
化学反应伴随着能量的变化。下列过程中的能量变化不是由化学反应引起的是A.天然气燃烧B.中和反应C.冰
化学反应伴随着能量的变化。下列过程中的能量变化不是由化学反应引起的是A.天然气燃烧B.中和反应C.冰的融化D.Ba(OH)2·8H2O晶体与NH4Cl晶体的充分反应












