(6分)(1)在一定条件下N2与H2反应生成NH3 请回答:①若反应物的总能量为E1 生成物的总能量
| (6分)(1)在一定条件下N2与H2反应生成NH3,请回答: ①若反应物的总能量为E1,生成物的总能量为E2,且E1 >E2,则该反应为 (填“吸热”或“放热”)反应。 ②已知拆开1mol H-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为________________________________。 (2)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。 已知:C(s,石墨)+O2(g)=CO2(g) △H1=Q1kJ·mol-1 2CO2(g)+H2 (g)=C2H2(g)+2O2(g) △H2=Q2kJ·mol-1。根据盖斯定律,计算此时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应的焓变为 kJ·mol-1(用含有Q1和Q2的式子表示)。 |
参考解答
(1)① 放热 (1分) ② N2(g)+ 3H2(g) 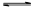 2NH3(g) △H=﹣92 kJ·mol-1 (3分) 2NH3(g) △H=﹣92 kJ·mol-1 (3分)(2) 2Q1+Q2 (2分) |
| (1)①反应物的总能量高于生成物的总能量,所以是放热反应。 ②反应热就是断键吸收的能量和形成化学键所放出的能量的差值,所以生成2mol氨气时的反应热是436KJ/mol×3+946 KJ/mol-3×2×391 KJ/mol=-92 KJ/mol,所以热化学方程式为N2(g)+ 3H2(g) 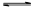 2NH3(g) △H='—92' kJ·mol-1。 2NH3(g) △H='—92' kJ·mol-1。(2)根据反应①C(s,石墨)+O2(g)=CO2(g)和反应②2CO2(g)+H2 (g)=C2H2(g)+2O2(g)可知,①×2+②即得到2C(s,石墨)+H2 (g)=C2H2(g),所以反应热就是2Q1+Q2。 |
相似问题
下表给出几种物质的熔点 对此有下列一些说法: ①CaCl
下表给出几种物质的熔点,对此有下列一些说法:①CaCl2属于离子晶体②SiCl4是分子晶体 ③一个SiO2分子由1个Si原子和2个O原子构成 ④SiO2在熔融状态下能
下列说法正确的是A.离子晶体中 一个阴离子可同时与多个阳离子间有静电作用B.离子化合物中的阳离子 只
下列说法正确的是A.离子晶体中,一个阴离子可同时与多个阳离子间有静电作用B.离子化合物中的阳离子,只能是金属离子C.凡金属跟非金属元素化合时都形成
下列说法中不正确的是 A.共价化合物中不可能含有离子键B.有共价键的化合物 不一定是共价化合物C
下列说法中不正确的是A.共价化合物中不可能含有离子键B.有共价键的化合物,不一定是共价化合物C.离子化合物中可能存在共价键D.原子以极性键结合的分
下列物质中 既含有共价键又含有离子键的是A.NaOHB.NaClC.Na2OD.HCl
下列物质中,既含有共价键又含有离子键的是A.NaOHB.NaClC.Na2OD.HCl
下列说法正确的是( )A.含有金属元素的化合物一定是离子化合物B.第ⅠA族和第ⅦA族原子化合时 一
下列说法正确的是()A.含有金属元素的化合物一定是离子化合物B.第ⅠA族和第ⅦA族原子化合时,一定生成离子键C.由非金属元素形成的化合物一定不是离子












