A B C D E F G是原子序数依次增大的短周期元素 其中A与E D与G同主族 且D与G核内质子
| A、B、C、D、E、F、G是原子序数依次增大的短周期元素,其中A与E、D与G同主族,且D与G核内质子数之和是A与E核内质子数之和的2倍,A与B、C、D可分别形成10电子分子,E、F、G元素最高价氧化物对应水化物之间可相互发生反应,请回答下列问题 (1)E、G两种元素的符号:E______、G______;F在元素周期表中的位置是______. (2)Zn与稀硫酸反应需加入少量硫酸铜溶液反应速率会大大加快,其原理是______. (3)E在D2中燃烧生成化合物X中阴阳离子个数比为______;X中的阴离子电子式为______. (4)能够说明可逆反应2CD2(g)  C2D4(g)达到平衡状态的标志是______; ①单位时间消耗2mol CD2的同时,生成1mol C2D4 ②恒温恒压下,混合气体的密度不变 ③CD2和C2D4的浓度之比为2:1 ④混合气体的颜色不变 ⑤单位时间消耗4mol CD2的同时,消耗2mol C2D4 (5)向含E的最高价氧化物的水化物0.5mol的水溶液中通入标况下BD2气体11.2L,其化学反应方程式为______. |
参考解答
| A、B、C、D、E、F、G是原子序数依次增大的短周期元素,E、F、G元素最高价氧化物对应水化物之间可相互发生反应,最高价氧化物对应水化物只有氢氧化铝能与酸、碱反应,故其中一种为氢氧化铝,另外为强酸与强碱,短周期内,强碱为氢氧化钠,原子序数E、F、G是原子序数依次增大,故E为钠元素,F为铝元素,G为硫元素或氯元素;A与B、C、D可分别形成10电子分子,则A为氢元素;D与G同主族,且D与G核内质子数之和是A与E核内质子数之和的2倍,则D、G的原子序数中为2(1+11)=24,故D为氧元素,G为硫元素;B、C、D原子序数依次增大,都能与氢元素形成10电子分子,则B为碳元素,C为氮元素. 故A为氢元素;B为碳元素,C为氮元素,D为氧元素,E为钠元素,F为铝元素,G为硫元素; (1)由上述分析可知,E为Na;G为S;F为铝元素,原子核外有9个电子,有2个电子层,最外层电子数为7,处于周期表中第三周期第ⅢA族, 故答案为:Na;S;第三周期第ⅢA族; (2)发生反应Zn+CuSO4═ZnSO4+Cu,形成铜锌-硫酸原电池,反应速率加快, 故答案为:发生反应Zn+CuSO4═ZnSO4+Cu,形成铜锌-硫酸原电池,反应速率加快; (3)D为氧元素,E为钠元素,钠在氧气中燃烧,生成过氧化钠,过氧化钠中阴阳离子个数比为1:2;过氧根离子带2个单位的负电荷,氧原子之间形成1对共用电子对,电子式为 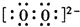 ,故答案为:1:2; 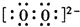 ; (4)①都表示正反应速率,反应自始至终都按该比例进行,不能说明到达平衡,故①错误; ②恒温恒压下,随反应进行混合气体的相对分子质量增大,密度不变,说明混合气体的平均相对分子质量不变,说明反应到达平衡,故②正确; ③反应到达平衡NO2与N2O4浓度之比可能为2:1,可能不是2:1,与开始的浓度及转化率有关,不能说明到达平衡,故③错误; ④、二氧化氮是红棕色,四氧化二氮无色,混合气体的颜色不变,说明二氧化氮的浓度不变,说明反应到达平衡,故④正确; ⑤单位时间消耗4mol NO2的同时消耗2mol N2O4,消耗4mol NO2,生成2molN2O4,消耗与生成的N2O4的物质的量相等,说明反应到达平衡,故⑤正确. 故答案为:②④⑤; (5)含0.5molNaOH的水溶液中通入标况下CO2气体11.2L,二氧化碳的物质的量为0.5mol,n(CO2):n(NaOH)=1:1,所以反应只生成碳酸氢钠,其化学反应方程式为NaOH+CO2=NaHCO3,故答案为:NaOH+CO2=NaHCO3. |
相似问题
A B C D E是五种短周期元素 原子序数依次增大.前四种的原子序数之和是E原子序数的二倍.E阳离
A、B、C、D、E是五种短周期元素,原子序数依次增大.前四种的原子序数之和是E原子序数的二倍.E阳离子与D阴离子都比A阳离子多2个电子层.D与四种元素中任
A B C D四种短周期主族元素 其原子序数依次递增 A元素的原子既能形成简单阳离子 又能形成简单阴
A、B、C、D四种短周期主族元素,其原子序数依次递增,A元素的原子既能形成简单阳离子、又能形成简单阴离子;B、C、D核电荷数总和为25,且B与C两元素能形
aYm+和bXn-两种离子 它们的电子层结构相同 若有①a=b+m+n ②a<b ③Ym+的离子半径
aYm+和bXn-两种离子,它们的电子层结构相同,若有①a=b+m+n,②a<b,③Ym+的离子半径小于Xn-的离子半径,其中正确的是( )A.①③B.②C.②③D.③
根据下表信息 判断以下叙述正确的是( )部分短周期元素的原子半径及主要化合价元素代号KLMNP原子
根据下表信息,判断以下叙述正确的是( )部分短周期元素的原子半径及主要化合价元素代号KLMNP原子半径 nm0 1360 1180 0890 1040 066主要化合价+2+3+2
某元素X 其原子的电子层数为(n-1) 最外层电子数为(2n-1).下列有关元素X的说法中正确的是(
某元素X,其原子的电子层数为(n-1),最外层电子数为(2n-1).下列有关元素X的说法中正确的是( )①元素X可能是金属元素 ②元素X的气态氢化物一定












