海水中富含氯元素。(1) KCl广泛应用于医药和农业 KCl晶体中Cl-的电子排布式为_______
| 海水中富含氯元素。 (1) KCl广泛应用于医药和农业,KCl晶体中Cl-的电子排布式为_____________________。 (2)下表是部分金属元素的电离能: |
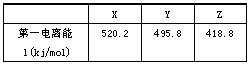 |
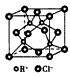
| 已知X、Y、Z的价层电子排布均为ns1,则三种金属的氯化物(RCI)的熔点由高到低的顺序为____________________。 (3)RC1用作有机合成催化剂,并用于颜料、防腐等工业。R+中所有电子正好充满K、L、M三个电子层,它与Cl 形成的晶体结构如下图所示。R的元素符号是__________,与同一个Cl-相连的R+有_________个。 |
 |
| (4)卤代烃在有机合成中作用巨大,烃基的结构对卤代烃的活性有很大的影响。CH3-CH2C1和碱溶液容易发生取代反应,而CH2=CH-C1和碱溶液不发生反应,请从结构上解释其差异___________________。 (5)HCl和HF结构相似,由于氢键的存在使两者性质上存在较大差异,请列举出由于氢键的影响导致的性质差异___________________________________。 |
参考解答
| (1)1s22s22p63s23p6 (2)ZCl 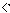 YCl YCl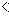 XCl XCl(3)Cu;4 (4)CH3-CH2-Cl中与Cl原子成键的C采取sp3杂化,而CH2=CH-Cl中与Cl原子成键的C采取sp2杂化,电子云密度不同;CH3-CH2-Cl中的C-Cl键的键长比CH2=CH-Cl中C-Cl键的键长要长;CH2=CH-Cl 中的π键对Cl的作用力比CH3-CH2-Cl中的C-Cσ键强 (5)HF的沸点比HCl高;氢氟酸是弱酸,盐酸足强酸;实验测得HF的相对分子质量偏大 |
相似问题
下列分子是含有极性共价键的非极性分子的是[ ]A.H2OB.CS2C.NH3D.H2
下列分子是含有极性共价键的非极性分子的是[ ]A.H2OB.CS2C.NH3D.H2
下列分子中 属于含有极性键的非极性分子[ ]A.CO2 B.Cl2 C.
下列分子中,属于含有极性键的非极性分子[ ]A.CO2 B.Cl2 C.CCl4 D.SO2
用Pauling的杂化轨道理论解释甲烷分子的四面体结构 下列说法不正确的是[ ]A.C原子的
用Pauling的杂化轨道理论解释甲烷分子的四面体结构,下列说法不正确的是[ ]A C原子的四个杂化轨道的能量一样B C原子的sp3杂化轨道之间夹角一样 C C原子
下列各组物质中 都是由极性键构成的极性分子的一组是 [ ]A CCl4和Br2 B NH3和
下列各组物质中,都是由极性键构成的极性分子的一组是 [ ]A、CCl4和Br2 B、NH3和H2O C、H2S和CS2 D、CO2和HCl
在极性溶剂中 如果溶质分子和溶剂分子之间可以形成氢键 则溶质的溶解度增大 由此可知 苯酚与硝基苯在水
在极性溶剂中,如果溶质分子和溶剂分子之间可以形成氢键,则溶质的溶解度增大,由此可知,苯酚与硝基苯在水中溶解度相比 [ ]A.前者大 B.后者大 C.












