下图为长式周期表的一部分 其中的编号代表对应的元素.请回答下列问题:(1)表中属于ds区的元素是__
下图为长式周期表的一部分,其中的编号代表对应的元素.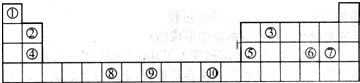 请回答下列问题: (1)表中属于ds区的元素是______(填编号). (2)表中元素①的2个原子与元素③的2个原子形成的分子中元素③的杂化类型是______;③和⑦形成的常见化合物的化学键类型是______. (3)元素⑧的外围电子排布式为______,该元素原子中未成对电子数为______. (4)在周期表中位于对角线的元素的性质也有一定的相似性.试写出元素②的氢氧化物与NaOH溶液反应的化学方程式:______. (5)在1183K以下,元素⑨形成如图1所示基本结构单元的晶体;1183K以上,转变为图2所示基本结构单元的晶体. 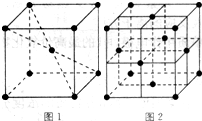 在1183K以下的晶体中,与元素⑨的原子等距离且最近的原子数为______; 在1183K以上的晶体中,与元素⑨的原子等距离且最近的原子数为______. |
参考解答
| (1)处于ds区的元素为第ⅠB和ⅡB,其中⑩位于第ⅠB,故属于ds区的元素为⑩,故答案为:⑩; (2)元素①为氢元素,元素③为碳元素,2个氢原子与的2个碳原子形成的分子中为乙烯,元素碳的杂化类型是sp杂化; 元素③为碳元素和元素⑦氯元素形成的常见化合物为四氯化碳,四氯化碳的化学键类型是极性共价键,故答案为:sp;极性共价键; (3)元素⑧为铬元素,位于第四周期第ⅥB族,价电子为六个,排布在s和d上,d上排五个电子形成半充满结构,比较稳定,故其外围电子排布式为3d54s1,六个电子均为单电子,故单电子数为 6个,故答案为:3d54s1;6; (4)在周期表中位于对角线的元素的性质有一定的相似性,根据对角线法则,铍元素与铝元素具有一定的相似性,氢氧化铝为两性氢氧化物,故氢氧化铍也为两性氢氧化物,生成相应的偏铍酸盐,化学方程式为2NaOH+Be(OH)2═Na2BeO2+2H2O,故答案为:2NaOH+Be(OH)2═Na2BeO2+2H2O; (5)在1183K以下,为左图所示,可知体心中有一个原子周围有八个原子,故每个晶胞中有8个原子与中心原子等距离且最近,在晶体中依然为8个,在1183K以上时为右图所示,以最上面中间原子为为例,同一个平面上有4个原子距离相等且距离最小,在竖直方向的四个面上,中间原子与所选定原子等距离且距离最小,在晶体中晶胞重复出现,故对面会有对称的四个竖直面上的点,一共12个,故答案为:8;12. |
相似问题
铜是重要金属 Cu的化合物在科学研究和工业生产中具有许多用途 如CuSO4溶液常用作电解液 电镀液等
铜是重要金属,Cu的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等。请回答以下问题:(1)用惰性电极电解硫酸铜溶液时
下列关于丙烯(CH3-CH=CH2)的说法错误的是( )A.丙烯分子有8个σ键 1个π键B.丙烯分
下列关于丙烯(CH3-CH=CH2)的说法错误的是( )A.丙烯分子有8个σ键,1个π键B.丙烯分子中3个碳原子都是sp3杂化C.丙烯分子存在非极性键D.丙烯分
现已知O3分子为V字形结构 O3在水中的溶解度和O2比较要大或小[ ]A.O3在水中的溶解度
现已知O3分子为V字形结构,O3在水中的溶解度和O2比较要大或小[ ]A.O3在水中的溶解度和O2一样B.O3在水中的溶解度比O2小 C.O3在水中的溶解度比O2要大D.没办法比较
下列各组中的分子 全部是以极性键形成的非极性分子的是( )A.H2 N2 Cl2B.CH4 NH3
下列各组中的分子,全部是以极性键形成的非极性分子的是( )A.H2、N2、Cl2B.CH4、NH3、H2OC.CO2、CS2、CCl4D.HCl、NO、Br2
CO.BF3.CCl4.CH4都是非极性分子 而NH3.H2S.H2O都是极性分子。由此推出ABn型
CO.BF3.CCl4.CH4都是非极性分子,而NH3.H2S.H2O都是极性分子。由此推出ABn型分子是非极性分子的经验规律正确的是 [ ]A.所有原子在同一平面内 B












