(12分)A B C D E五种均为短周期元素 原子序数依次增大。A元素原子最外层电子数是核外电子层
| (12分)A、B、C、D、E五种均为短周期元素,原子序数依次增大。A元素原子最外层电子数是核外电子层数的3倍,A与D同主族,A和D可形成化合物X’X可以使溴水褪色。A元素的单质和C元素的单质化合可生成Y, Y晶体中无分子,也无A、C的离子。A、B元素的单质一定条件下反应生成化合物M,D、B元素的单质反应生成化合物N,化合物M和化合物N的相对分子质量相等,且馅色反应均呈黄色。 请回答下列问题: (1) 元素C的气态氢化物是________分子(填写“极性”或“非极性”)。 (2) B2D2的电子式是________________ (3) X可以使溴水褪色,该反应的离子方程式是________________________。 (4) 化合物M与化合物N的水溶液反应,若氧化剂与还原剂物质的量之比为1: 1,该反应的离子方程式是________ (5) 右图是BE晶体的一个“晶胞结构”示意图。下列说法正确的是________________。 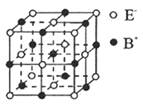 A. 与B+距离相等且最近的E_共有6个 B. —个BE晶胞中含有1个B +和1个E_ C. 与B+距离相等且最近的B+有8个 D. 与B+距离相等且最近的构成的空间结构是正八面体 (6) 将原子序数介于B、C两元素之间的单质、单质B与水反应所得的溶液构成原电池,负极的电极反应式是:O |
参考解答
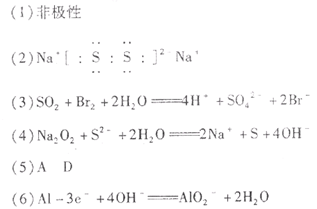 |
| 由题可分析得A、B、C、D、E对应的元素分别为:O、Na、Si、S、CL;X对应的物质为SO2气体;所以 (1)元素C的气态氢化物是SiH4,空间结构为正四面体形,由极性键构成的非极性分子 (2)B2D2的分子式为:Na2S2,其电子式是: 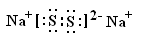 (3)SO2具有还原性,可以使溴水褪色,该反应的离子方程式是:  (4)化合物M(Na2O2)与化合物N(Na2S)的水溶液反应:  (5)BE晶体为NaCL晶体;所以A、D正确; (6)由信息提示可知B、C之间的一种元素为AL,其电极反应式为:  |
相似问题
下列叙述正确的是A.水结成冰体积膨胀 密度变小 这一事实与水中存在氢键有关B.共价化合物可能含有离子
下列叙述正确的是A.水结成冰体积膨胀、密度变小,这一事实与水中存在氢键有关B.共价化合物可能含有离子键C.离子化合物中只含有离子键D.阴、阳离子之
下列不能形成配位键的组合是( )A.Ag+ NH3B.BF3 NH3C.Co3+ COD.Ag+
下列不能形成配位键的组合是( )A.Ag+、NH3B.BF3、NH3C.Co3+、COD.Ag+、H+
下列说法中不正确的是 A.共价化合物中一定不含有离子键 离子化合物中可能含有共价键B.充电电池的化学
下列说法中不正确的是 A.共价化合物中一定不含有离子键,离子化合物中可能含有共价键B.充电电池的化学反应原理是氧化还原反应C.一定条件下,将1 mol
下列化学式能真实表示物质分子组成的是( )A.NaOHB.SO2C.P(白磷)D.SiO2
下列化学式能真实表示物质分子组成的是()A.NaOHB.SO2C.P(白磷)D.SiO2
通常状况下 NC13是一种油状液体 其分子空间构型与氨分子相似 下列对NC13的有关叙述正确的是 (
通常状况下,NC13是一种油状液体,其分子空间构型与氨分子相似,下列对NC13的有关叙述正确的是()A.分子中N—C1键键长比CCl4分子中C—C1键键长更长B.












