碳是形成化合物最多的元素。(1)由碳元素参与形成的物质多为分子晶体 也有少数原子晶体。下列关于分子晶
| 碳是形成化合物最多的元素。 (1)由碳元素参与形成的物质多为分子晶体,也有少数原子晶体。下列关于分子晶体和原子晶体的说法正确的是 (填字母序号)。 A、完全由非金属元素形成的物质一定是分子晶体或原子晶体 B、分子晶体中分子之间一定存在范德华力 C、SiC具有极高的熔点和较大的硬度,SiC分子中除存在共价键外,还存在分子间作用力 D、金刚石是由碳元素形成的原子晶体,性质稳定,不与任何物质反应 (2)意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的C4分子。C4分子结构如图所示。下列说法正确的是 。 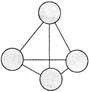 A、C4属于一种新型的化合物 B、C4与P4(白磷)的晶体都属于分子晶体 C、C4气体分子内含有极性共价键 D、C4与C60互为同素异形 (3)与碳同主族元素锗为32号元素,与锗同周期,且未成对电子数与锗相同,电负性最大的元素的价电子排布式为 。 (4)邻硝基苯酚的熔点 对硝基苯酚(填“>”、“=”或“<”=)。 (5)硼、碳、氮、氧是元素周期表第二周期相邻的四种元素。下列有关的四种化合物中,键角最小的是 。 A、CO2 B、CF4 C、NF3 D、OF2 已知硼酸H3BO3为白色固体,溶于水显弱酸性,但它却是一元酸,可以用硼酸在水溶液中的电离平衡解释它是一元弱酸的原因。 请写出下面这个方程式右端的两种离子的表达式: 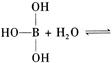 。 。 |
参考解答
| (6分)(1)B (2)BD (3)4s24p4 (4)< (5)D 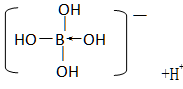 |
试题分析:(1)A项:NH4Cl是离子晶体,故错;C项:SiC是原子晶体,不存在分子间作用力,故错;D项:金刚石可以燃烧,故错。故选B。 (2)A项:C4是一种只由N元素组成的纯净物,为单质,故错;C项:C和C之间是非极性共价键,故错。故选BD。 (3)是硒元素,其价电子排布式为4s24p4。 (4)对-硝基苯酚分子间形成氢键,故邻硝基苯酚的熔点小于对硝基苯酚的熔点。 (5)A是180°,B是109°28′,C是120°,D是103.2°。故选D。 呈弱酸性,说明电离出了H+,故离子的表达式为 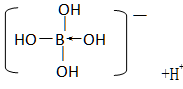 。 。点评:本题考查的是晶体、化学键、子的核外电子排布、氢键、键角和电离平衡等综合知识,题目难度中,注意基础知识的学习、掌握和应用。 |
相似问题
微粒中的质子数是________ 中子数是________ 核外电子数是________。它与Na形
微粒中的质子数是________,中子数是________,核外电子数是________。它与Na形成的化合物的电子式________,此化合物类型________(填“离子化合物”或“共价化合物”)。
三氟化氮(NF3)在微电子工业中有重要用途 它在潮湿的空气中与水蒸气反应的产物有:HF NO和HNO
三氟化氮(NF3)在微电子工业中有重要用途,它在潮湿的空气中与水蒸气反应的产物有:HF、NO和HNO3。则下列说法正确的是A.NF3分子中含有非极性共价键B.N
下列叙述中正确的是( )A.NH3 CO CO2都是极性分子 B.CH4 CCl4都是含有极性键的
下列叙述中正确的是( )A.NH3、CO、CO2都是极性分子 B.CH4、CCl4都是含有极性键的非极性分子C.HF、HCl、HBr、HI的稳定性依次增强D.CS2、H2O、C2H2都是直线形分子
物质的下列性质不能用键能来解释的是( )A.氮气的化学性质没有氯气活泼B.HF比HCl稳定C.金刚
物质的下列性质不能用键能来解释的是( )A.氮气的化学性质没有氯气活泼B.HF比HCl稳定C.金刚石的熔点比晶体硅高D.常温下溴呈液态,碘呈固态
元素R的质量数为A Rn-的核外电子数为x 则WgRn-所含中子的物质的量为[ ]A.(A-
元素R的质量数为A,Rn-的核外电子数为x,则WgRn-所含中子的物质的量为[ ]A.(A-x+n)molB.(A-x-n)mol C.mol D.mol












