(15分)氮化硅是一种重要的结构陶瓷材料 硬度大 耐磨损。利用SiO2和C的混合粉末在N2的气氛中加
| (15分)氮化硅是一种重要的结构陶瓷材料,硬度大、耐磨损。利用SiO2和C的混合粉末在N2的气氛中加热至1300℃反应制得。请回答下列问题: (1)已知氮化硅的晶体结构中,原子间都以单键相连,且N原子和N原子,Si原子与Si原子不直接相连,同时每个原子都满足8电子稳定结构,则氮化硅的化学式____,晶体类型是 ; (2)基态Si原子的电子排布式为_________;Si和C相比,电负性较大的是_________, (3)在SiO2晶体结构中,O-Si-O的键角是_______,Si原子和周围的四个O原子组成的空间构型为 ,SiO2中Si的杂化类型_______; (4)氮化硅抗腐蚀能力强,一般不与其他无机酸反应,但能和氢氟酸反应生成硅酸。试写出该反应的化学方程式 。 (5)晶体硅的晶胞如图所示,则每个晶体硅的晶胞中含有 个硅原子。 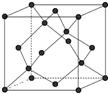 |
参考解答
| (1) Si3N4 (2分)原子晶体(1分) (2) 1s22s22p63s22p2 (2分) C (1分) (3) 109°28′(1分) 正四面体(2分)sp3(2分) (4) Si3N4+4HF+9H2O=3H2SiO3↓+4NH4F(2分) (5) 8(2分) |
| (1)每个原子都满足8电子稳定结构,所以其化合价分别是+4价和-3价,因此化学式为Si3N4。由于晶体中的微粒是原子,所以形成的晶体是原子晶体。 (2)根据构造原理可知,基态Si原子的电子排布式为 1s22s22p63s22p2 。非金属性越强,电负性越大,所以碳的电负性大于硅的。 (3)由于在SiO2晶体结构中,Si原子和周围的四个O原子相邻,所以构成的应是正四面体,采用的是sp3杂化,O-Si-O的键角是 109°28′。 (4)能和氢氟酸反应生成硅酸,则根据原子守恒可知,另外一种生成物是NH4F,所以方程式为Si3N4+4HF+9H2O=3H2SiO3↓+4NH4F。 (5)根据晶体硅的晶胞结构可知,8个顶点有8个硅原子,6个面心处有6个硅原子,晶胞内部还有4个硅原子,所以共计是8×1/8+6×1/2+4=8个。 |
相似问题
氮氧化铝(AlON)属原子晶体 是一种超强透明材料 下列描述错误的是( )A.AlON和石英的化
氮氧化铝(AlON)属原子晶体,是一种超强透明材料,下列描述错误的是()A.AlON和石英的化学键类型相同B.AlON和石英晶体类型相同C.AlON和(工业上通过电
下列物质的按熔沸点升高顺序排列的是A.Li Na K RbB. NaF NaCl NaBr NaIC
下列物质的按熔沸点升高顺序排列的是A.Li Na K RbB. NaF NaCl NaBr NaIC.F2 Cl2 Br2 I2D.H2O H2S H2Se H2Te
(3分)①NaCl ②干冰 ③冰 ④Na2O2 ⑤白磷(P4) ⑥金刚石 ⑦Na2CO3 ⑧钠。以上
(3分)①NaCl、②干冰、③冰、④Na2O2、⑤白磷(P4)、⑥金刚石、⑦Na2CO3、⑧钠。以上物质中属于离子晶体的是 ________ ;属于分子晶体的是(填序号
已知氯化铝易溶于苯和乙醚 其熔点为190℃ 则下列结论错误的是A.氯化铝是电解质B.固体氯化铝是分子
已知氯化铝易溶于苯和乙醚,其熔点为190℃,则下列结论错误的是A.氯化铝是电解质B.固体氯化铝是分子晶体C.可用电解熔融氯化铝的办法制取金属铝D.氯化
要使金属晶体熔化必须破坏其中的金属键。金属晶体熔 沸点高低和硬度大小一般取决于金属键的强弱 而金属键
要使金属晶体熔化必须破坏其中的金属键。金属晶体熔、沸点高低和硬度大小一般取决于金属键的强弱,而金属键的强弱与金属阳离子所带电荷的多少及半径大小












