原子序数小于36的X Y Z W四种元素 其中X是形成化合物种最多的元素 Y原子基态时最外层电子数是
| 原子序数小于36的X、Y、Z、W四种元素,其中X是形成化合物种最多的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29. 回答下列问题: (1)Y2X2分子中Y原子轨道的杂化类型为______,1mol Y2X2含有σ键的数目为______. (2)化合物ZX3的沸点比化合物YX4的高,其主要原因是______. (3)元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物的分子式是______. (4)元素W的一种氯化物晶体的晶胞结构如图所示,该氯化物的化学式是______,它可与浓盐酸发生非氧化还原反应,生成配合物H2WCl3,反应的化学方程式为______. 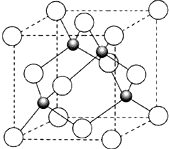 |
参考解答
| 原子序数小于36的X、Y、Z、W四种元素,其中X是形成化合物种类最多的元素,则X是H元素; Y原子基态时最外层电子数是其内层电子数的2倍,最外层电子数不超过8,所以内层电子数只能是2,则Y是C元素; Z原子基态时2p原子轨道上有3个未成对的电子,则Z是N元素,W的原子序数为29,则W是Cu元素. (1)Y2X2是乙炔,分子式为C2H2,碳氢原子之间存在σ键,碳碳三键中含有一个σ键,所以每个碳原子含有2个σ键,采取sp杂化,一个乙炔分子中含有3个σ键,所以1mol Y2X2含有σ键3mol或3×6.02×1023个, 故答案为:sp杂化;3mol或3×6.02×1023个; (2)N原子电负性较大,C原子电负性较小,所以氨气分子中存在氢键,甲烷分子中不含氢键,氢键的存在导致氨气的沸点大于甲烷,故答案为:NH3分子存在氢键; (3)CO2和N2O的原子个数相等、价电子数相等,所以是等电子体,故答案为:N2O; (4)利用均摊法知,该晶胞中黑色球个数=4,白色球个数=
故答案为:CuCl;CuCl+2HCl═H2CuCl3(或CuCl+2HCl═H2[CuCl3. |
相似问题
16.下列分子中 键能最小的是 ( )A.F2B.Br2C.Cl2D.N2
16.下列分子中,键能最小的是()A.F2B.Br2C.Cl2D.N2
下列现象不能用“相似相溶原理”来解释的是 [ ]A.大多数有机物难溶于水B.在苯中同时通入氨
下列现象不能用“相似相溶原理”来解释的是 [ ]A.大多数有机物难溶于水B.在苯中同时通入氨气和氯化氢,可以发现有白色沉淀出现 C.乙醇和水不能直接
(1)①短周期某主族元素M的第一电离能情况如图(1)所示。则M元素位于周期表的第__________
(1)①短周期某主族元素M的第一电离能情况如图(1)所示。则M元素位于周期表的第__________族。 ②图(2)折线c可以表达出第______族元素氢化物的沸点的变化
手性分子是指在分子结构中 当a b x y为彼此互不相同的原子或原子团时 称此分子为手性分子 中心碳
手性分子是指在分子结构中,当a、b、x、y为彼此互不相同的原子或原子团时,称此分子为手性分子,中心碳原子为手性碳原子。下列分子中指定的碳原子(用*标
已知A B C D E F都是周期表中前四周期的元素 它们的核电荷数A
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F。其中B、D、F原子最外电子层的p能级(轨道)上的电子处于半满状态。通常情况












