(三选一)【物质结构与性质】下表中实线是元素周期表的部分边界 其中上边界并未用实线标出。 根据信息回
| (三选一)【物质结构与性质】 下表中实线是元素周期表的部分边界,其中上边界并未用实线标出。 |
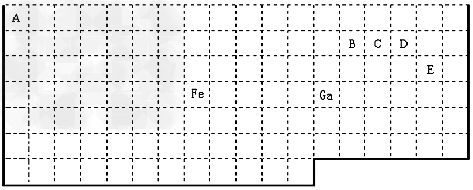 |
| 根据信息回答下列问题: (1)周期表中比Ga质子数少2的基态原子价电子排布式为_____________。 (2)Fe元素位于周期表的____分区;Fe与CO易形成配合物Fe(CO)5,在Fe(CO)5中铁的化合价为__________;已知:原子数目和电子总数(或价电子总数)相同的微粒互为等电子体,等电子体具有相似的结构特征。与CO分子互为等电子体的分子和离子分别为______和_____(填化学式),CO的结构式为_____________。 (3)在CH4、CO及CH3OH中,碳原子采取sp3杂化的分子为________________。 (4)根据VSEPR理论预测ED4-离子的空间构型为______________型。B、C、D及E原子相互化合形成的分子中,所有原子都满足最外层8电子稳定结构的电子式为:__________________________________(写2种) (5)B与D形成的稳定化合物为___________分子(填“极性”“非极性”),其固态为________晶体。 |
参考解答
| (1)3d104s1 (2)d;0;N2;CN-;C≡O (3)CH4CH3OH (4)正四面体; 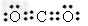 、 、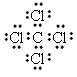 (答案合理即可) (答案合理即可)(5)非极性;分子 |
相似问题
下列对实验现象的描述正确的是A.Na在空气中燃烧产生苍白色的火焰B.Cu在氯气中燃烧产生绿色的烟
下列对实验现象的描述正确的是A.Na在空气中燃烧产生苍白色的火焰B.Cu在氯气中燃烧产生绿色的烟C.氢氧化钡晶体与氯化铵晶体混合,能够吸收环境的
氨气分子空间构型是三角锥形 而甲烷是正四面体形 这是因为[ ]A.两种分子的中心原子杂化轨道
氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为[ ]A.两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化B.NH3分子中
下列分子中心原子是sp2杂化的是 [ ]A.PBr3 B.CH
下列分子中心原子是sp2杂化的是[ ]A.PBr3B.CH4C.BF3D.H2O
在半导体生产或灭火剂的使用中 会向空气逸散气体如:NF3 CHClFCF3 C3F8 它们虽是微量的
在半导体生产或灭火剂的使用中,会向空气逸散气体如:NF3、CHClFCF3、C3F8,它们虽是微量的,有些确是强温室气体,下列推测不正确的是( )A.熔点NF3
对于SO2和CO2的说法中正确的是( )A.都是直线形结构B.中心原子都采用sp杂化类型C.SO2
对于SO2和CO2的说法中正确的是( )A.都是直线形结构B.中心原子都采用sp杂化类型C.SO2为V形结构,CO2为直线形结构D.S原子和C原子上都没有孤对电子












