已知A B C D E都是周期表中前四周期的元素 它们的核电荷数A<B<C<D<E。其中A B C是
| 已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC形成的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为29。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示) (1)AC2在H2C(C的氢化物)中的溶解度不大,其主要原因是_________________________。 (2)B的氢化物的分子空间构型是______________。其中心原子采取______________杂化。 (3)写出化合物AC2的电子式______________;一种由B、C组成的化合物与AC2互为等电子体,其化学式为______________。 (4)向ESO4中逐滴加氨水至氨水过量,其现象为______________;产生此现象的原因(用离子方程式表示) ______________;______________。 (5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是____________________________。 |
参考解答
| (1)CO2是非极性分子,H2O是极性分子,根据相似相容原理,CO2在H2O中的溶解度不大 (2)三角锥形;sp3 (3) 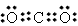 ;N2O ;N2O(4)先出现蓝色絮状沉淀,沉淀溶解成深蓝色溶液;Cu2++2NH3·H2O=Cu(OH)2↓ +2NH4+; Cu(OH)2+4NH3=[Cu(NH3)42++2OH- (5)4Mg+10HNO3=4Mg(NO3)2+NH4NO3+3H2O |
相似问题
配离子[Cu(NH3)4]2+中 中心离子的配位数是[ ]A.1B.2C.4D.6
配离子[Cu(NH3)4]2+中,中心离子的配位数是[ ]A.1B.2C.4D.6
下列物质中 分子的立体结构与水分子相似的是[ ]A.CO2 B.H2S C.PCl3 D.S
下列物质中,分子的立体结构与水分子相似的是[ ]A.CO2 B.H2S C.PCl3 D.SiCl4
Langmuir提出等电子体的概念:原子总数相同 电子总数或价电子总数相同的粒子互为等电子体 等电子
Langmuir提出等电子体的概念:原子总数相同、电子总数或价电子总数相同的粒子互为等电子体,等电子体通常具有结构相似的特征。下列各对粒子中,空间结构
下列物质熔沸点高低比较正确的是A.SiO2
下列物质熔沸点高低比较正确的是A.SiO2<CO2B.CCl4<CF4C.NaCl<HClD.HF>HCl
X Y Z W Q R六种短周期主族元素 原子序数依次增大 Z基态原子核外有三个未成对电子 Y Z
X、Y、Z、W、Q、R六种短周期主族元素,原子序数依次增大,Z基态原子核外有三个未成对电子,Y、Z、W分别与X形成常见化合物的分子结构依次为正四面体、三角












