(1)+3价Co的配合物CoClm·nNH3 中心原子的配位数为6 若1 mol该配合物与足量AgN
| (1)+3价Co的配合物CoClm·nNH3,中心原子的配位数为6,若1 mol该配合物与足量AgNO3溶液反应生成1 mol AgCl沉淀,用配合物形式写出该配合物的化学式 。 (2)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大磁记录性能越好。离子型氧化物MnO2和Fe3O4及Cr2O3中,磁性最大的是___________。 (3)碳纳米管有单层或多层石墨层卷曲而成,其结构类似于石墨(如下左图),每个碳原子通过 杂化与周围碳原子成键。 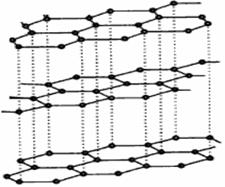 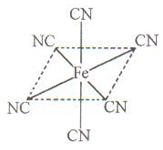 (4)铁元素应用广泛,Fe2+与KCN溶液反应得Fe(CN)2沉淀,当加入过量KCN溶液时沉淀溶解,生成黄血盐,其配离子结构如上右图。 ①已知CN—与N2结构相似,1molCN-中 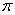 键数目为 。 键数目为 。②上述沉淀溶解过程的化学方程式为 。 |
参考解答
| (10分)(1)[CoCl2(NH3)4Cl(2)Fe3O4(3)sp2 (4)①2NA ② 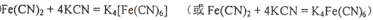 (各2分) (各2分) |
试题分析:(1)1 mol该配合物与足量AgNO3溶液反应生成1 mol AgCl沉淀,这说明该配位化合物中有1个氯离子不是配体。又因为Cr是+3价的,则氯原子的购书是3个,由于配位数是6,所以化学式应该是[CoCl2(NH3)4Cl。 (2)根据核外电子排布式可知,离子型氧化物MnO2和Fe3O4及Cr2O3中金属阳离子含有的未成对电子分别是3、14/3、3,所以磁性最大的Fe3O4。 (3)石墨是层状结构,所以每个碳原子通过sp2杂化与周围碳原子成键。 ①CN—与N2结构相似,氮气中含有三键,有2个 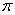 键,所以1molCN-中 键,所以1molCN-中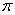 键数目为2NA。 键数目为2NA。②根据结构式可知,分子中含有配位健,且配位数是6,所以沉淀溶解过程的化学方程式为Fe(CN)2+4KCN=K4Fe(CN)6。  键的判断和有关计算 键的判断和有关计算点评:该题是高考中的常见题型和考点,属于中等难度试题的考查。试题综合性强,在注重对学生基础知识巩固和训练的同时,侧重对学生解题能力和方法的培养与训练,有利于培养学生的逻辑推理能力和发散思维能力,提高学生灵活运用基础知识解决实际问题的能力,旨在考查学生对知识的掌握与利用。 |
相似问题
有下列离子晶体的空间结构示意图。图中●和化学式中M分别代表阳离子 图中○和化学式中N分别代表阴离子
有下列离子晶体的空间结构示意图。图中●和化学式中M分别代表阳离子,图中○和化学式中N分别代表阴离子,则化学式为MN2的晶体结构为()AB C D
根据下表给出的几种物质的溶沸点数据 判断下列说法中错误的是 ( ) NaC
根据下表给出的几种物质的溶沸点数据,判断下列说法中错误的是()NaClMgCl2AlCl3SiCl4单质B熔点 ℃810710180-682300沸点 ℃14651418160572500A、SiCl4是
氯化硼(BCl3)的熔点为-107℃ 沸点为12.5℃ 在其分子中键与键之间的夹角为120° 它能与
氯化硼(BCl3)的熔点为-107℃,沸点为12 5℃,在其分子中键与键之间的夹角为120°,它能与水反应。下列有关叙述中正确的是( )A.氯化硼液态时能导
下列晶体中:①干冰 ②铜 ③碘 ④氯化钙 ⑤二氧化硅 ⑥氧化钠 ⑦硝酸铵 ⑧金刚石
下列晶体中:①干冰 ②铜 ③碘 ④氯化钙 ⑤二氧化硅 ⑥氧化钠 ⑦硝酸铵 ⑧金刚石 ⑨氩 ⑩铁属于分子晶体、离子晶体、原子晶体、金属晶体的种数
下列物质的熔 沸点高低顺序正确的是( )A.金刚石>晶体硅>二氧化硅>碳化硅B.CI4>CBr4
下列物质的熔、沸点高低顺序正确的是()A.金刚石>晶体硅>二氧化硅>碳化硅B.CI4>CBr4>CCl4>CF4C.K2O>Na2O>O2>N2D.干冰 >二氧化硅>氯化钠>钠












