A B C D E F六种短周期元素 原子序数依次增大 A E同主族 D F同主族 A元素的原子半径
| A、B、C、D、E、F六种短周期元素,原子序数依次增大,A、E同主族,D、F同主族,A元素的原子半径是所有原子中最小的,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y,A、B、C、E、F五种元素都能与D元素形成原子个数比不相同的常见化合物.回答下列问题: (1)F元素在周期表中的位置______,在以上元素最高价氧化物的水化物中,碱性最强的化合物的电子式是:______. (2)D、F的气态氢化物,沸点较高的是______(填分子式). (3)A单质与C单质在一定条件下可化合为Z,常温下,向pH=a的Z的水溶液中加入等体积pH=b的X的水溶液,且a+b=14,充分作用后,溶液pH______7(填“>”“<”或“=”),原因是______. |
参考解答
| A元素的原子半径是所有原子中最小的,则A为氢元素;B元素原子的最外层电子数是内层电子数的2倍,则B为碳元素;C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y,Y为硝酸铵,则C为氮元素;A、B、C、D、E、F六种短周期元素,原子序数依次增大,A、E同主族,则E为钠元素;D、F同主族,A、B、C、E、F五种元素都能与D元素形成原子个数比不相同的常见化合物,则D为氧元素,F为硫元素; (1)硫原子有3个电子层,最外层电子数为6,则在周期表中第三周期第ⅥA族,只有钠为金属,则氢氧化钠的碱性最强,其电子式为 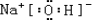 , 故答案为:第三周期第ⅥA族; 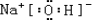 ; (2)因D、F的气态氢化物分别为H2O、H2S,水分子之间含有氢键,则沸点高,故答案为:H2O; (3)A单质与C单质在一定条件下可化合为Z,则Z为氨气,pH=a的氨水溶液中加入等体积pH=b的硝酸的水溶液,且a+b=14,则反应后为氨水和硝酸铵的混合溶液,溶液pH>7,弱电解质的电离大于盐类的水解,故答案为:>;弱碱与盐的混合溶液真弱碱的电离大于盐中弱碱阳离子的水解. |
相似问题
短周期元素A B C原子序数依次递增 它们的原子的最外层电子数之和为10.A与C在周期表中同主族 B
短周期元素A、B、C原子序数依次递增,它们的原子的最外层电子数之和为10.A与C在周期表中同主族,B原子最外层电子数等于A原子次外层电子数.下列叙述正确
短周期元素甲和乙 甲原子的最外层电子数为a 次外层电子数为b;乙原子的M层电子数为 L层电子数为。则
短周期元素甲和乙,甲原子的最外层电子数为a,次外层电子数为b;乙原子的M层电子数为,L层电子数为。则甲、乙两元素形成的化合物具有的性质是[ ]①与水
主族元素X的原子最外电子层中具有最多的未成对电子 元素Y的原子只有两种形状的电子云 且两种电子云的电
主族元素X的原子最外电子层中具有最多的未成对电子,元素Y的原子只有两种形状的电子云,且两种电子云的电子数相等,则X、Y组成的微粒中,不可能存在的是
短周期元素X Y Z组成的化合物Y2X和ZX2.Y2X溶于水形成的溶液能与ZX2反应生成一种化合物Y
短周期元素X、Y、Z组成的化合物Y2X和ZX2.Y2X溶于水形成的溶液能与ZX2反应生成一种化合物Y2ZX3.已知三种元素原子的质子总数为25,且Z和Y的原子序数之和
短周期元素W X Y Z的原子序数依次增大 其中W的阴离子的核外电子数与X Y Z原子的核外内层电子
短周期元素W、X、Y、Z的原子序数依次增大,其中W的阴离子的核外电子数与X、Y、Z原子的核外内层电子数相同.X的一种核素在考古时常用来鉴定一些文物的年代












